О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИ
ХРОМОНЕМНЫЙ (ЧЕТВЕРТЫЙ) УРОВЕНЬ УПАКОВКИ ХРОМАТИНА
НЕРИБОСОМНЫЕ ПРОДУКТЫ КЛЕТОЧНОГО ЯДРА
ЯДЕРНАЯ ОБОЛОЧКА

Транскрипция нерибосомных генов
Информационные РНК образуются при участии РНК-полимеразы II, начинающей синтез со стартовой точки транскрипционной единицы и кончающей его в точке терминации. При этом образуется одна молекула РНК — транскрипт, предшественник информационной РНК, Размер транскрипционных единиц разных генов может значительно варьировать от 6 тыс. до 200 тыс. нуклеотидов. Поэтому суммарная фракция РНК, синтезированная на разных генах, содержит молекулы различной длины. Эта первично синтезированная РНК, или так называемая гетерогенная ядерная РНК (гяРНК), встречается только в ядре и не обнаруживается в цитоплазме. В цитоплазму попадает уже информационная РНК, образующаяся в результате изменений в ядре первичных транскриптов РНК (гяРНК).
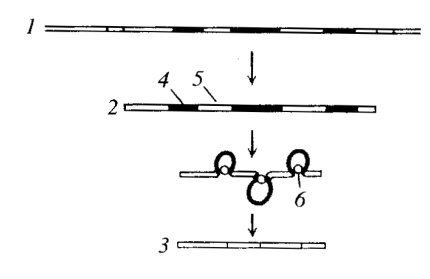
Величина гяРНК в несколько раз больше той, которая требуется для синтеза белков: для синтеза «среднего белка», состоящего из 400 аминокислот, необходима матричная РНК в 1200 нуклеотидов. На самом деле величины информационных РНК в составе синтезирующих белок полисом в несколько раз короче первичных транскриптов. Это укорочение является результатом «созревания» гяРНК-процессинга, но иного характера, чем процессинг рибосомных РНК. Структура гена эукариот оказалась состоящей из чередующихся последовательностей нуклеотидов — экзонов и интронов. Экзоны — участки ДНК, которые обладают кодирующей информацией и входят в состав информационных РНК, а интроны содержат последовательности, не входящие в информационную РНК. Первичный транскрипт РНК содержит полную копию гена, включает в себя все последовательности, как экзоны, так и интроны. Интроны впоследствии вырезаются из первичного трапскрипта, концы же фрагментов РНК сшиваются ковалентно, что приводит к общему укорачиванию образовавшейся молекулы информационной РНК. Этот процесс получил название сплайсинга. Так как большинство генов млекопитающих содержит большее число интронов, чем экзонов, процесс сплайсинга РНК приводит к тому, что очень длинные молекулы гяРНК (первичных транскриптов, содержащих более чем 50 000 нуклеотидов) укорачиваются до длины цитоплазматических иРНК (обычно от 500 до 3000 нуклеотидов длиной) (рис. 97).
|
Рис. 97. Созревание (сплайсинг) гетерогенных ядерных (гя) РНК 1 — матрица ДНК; 2 — гяРНК — первичный транскрипт; 3 — мРНК; 4 — интроны; 5 — экзоны; 6 — сплайсосома |
По мере синтеза и роста гяРНК она связывается с рядом ядерных белков, образуя гяРНП-частицы (гетерогенные ядерные рибонуклеопротеиновые частицы). При этом высокомолекулярная гяРНК в ядрах наматывается на глобулярные белковые частицы — информоферы. На каждый информофер приходится отрезок РНК длиной около 500—600 нуклеотидов. Такой комплекс информофера и РНК образует мономер или 30S частицу. В состав каждого информофера входит более 30 белковых молекул информатина. Таким образом, первичный транскрипт структурного гена, отвечающего за образование информационной РНК, представляет собой гигантскую молекулу гяРНК, связанную со множеством белковых частиц - информофер. Считается что участки гяРНК между информоферами могут быть использованы для сплайсинга с помощью специальных белковых комплексов — сплайсосом. В состав сплайсосом входят 5—7 малых ядерных рибонуклеопротеидов (мяРНП, или snRNP - small nuclear ribonucleoprotein). Эти особые малые ядерные РНП (мяРНП) представляют собой РНП-частицы (U1, U2, U5, U4, U6 snRNP) с константой седиментации около 10S. В каждой частице содержится одна малая молекула РНК (90-400 нуклеотидов) и около семи молекул белка. Так что сплайсосома представляет собой крупный рибонуклеопротеидный комплекс величиной, сравнимой с рибосомой (константа седиментации около 60S).
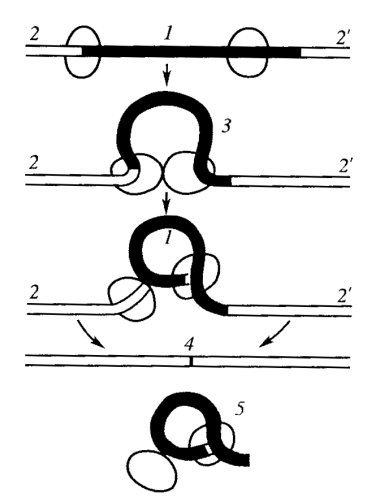
При синтезе гяРНК и после него сплайсосомы связываются с цепью РНК в местах на границе между экзонами и нитронами, специфически узнавая эти места, производят разрыв в основании петли интрона и сшивают свободные концы (рис. 98). Таким способом участки интронных последовательностей вычленяются из состава первичного транскрипта, а затем быстро деградируют в ядре. В результате этого процесса длина результирующей молекулы РНК может укорачиваться в несколько раз. Например, размер гена белка тироглобулина включает 300 тыс. нуклеотидов, размер же иРНК для этого белка составляет всего 8,7 тыс. нуклеотидов из-за того, что в составе гена включены 36 интронных последовательностей, т.е. происходит укорочение молекул РНК более чем в 30 раз. Размер гена каталазы равен 34 т.п.н., а размер иРНК - 1,6 т.п.н. Величина овальбуминового гена у птиц составляет 7,5 т.п.н., а соответствующая этому гену зрелая и РНК— всего 1,8 т.п.н. Обычно иРНК в 2,5—10 раз короче первичного транскрипта - гяРНК.
|
Рис. 98. Последовательное вырезание интрона и сплайсинга экзонов 1 — интрон; 2, 2' — экзоны; 3 — образование сплайсосомы; 4 — зрелая иРНК; 5 — вырезанный интрон |
Считается, что после созревания иРНК при переходе из ядра в цитоплазму теряет белки, входящие в состав информофера, «переодевается» в ядерной поре, а белки информофер остаются в ядре. В цитоплазме иРНК снова одеваются новыми белками, образуя «информосомы» - форму хранения иРНК в неактивном состоянии, или связываются с белками, необходимыми для трансляции.

Морфология РНП-компонентов ядра
Вся информация о морфологии транскриптов рРНК и иРНК, об информоферах и сплайсосомах получена в результате изучения выделенных из ядер этих компонентов, подвергнутых специальной обработке для распластывания их на препаратах для электронной микроскопии. Что же касается морфологии РНП-продуктов in situ , в объеме интактных ядер, то здесь информация неполная и противоречивая.
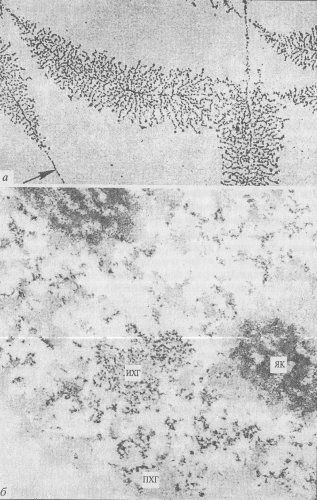
Кроме хорошо выраженного ядрышка другие продукты ядерной активности при изучении клеток на ультратонких срезах не бросаются в глаза: их трудно отличить от различных фибрилл (ДНП, матрикс) и каких-то гранул, казалось бы, без особого порядка разбросанных в ядре. Все же, используя метод избирательного контрастирования солями урана структур, содержащих РНК, удается выделить ряд компонентов, которые можно отнести к неядрышковым продуктам транскрипции. Это - перихроматиновые фибриллы, перихроматиновые гранулы и интерхроматиновые гранулы (рис. 99, б и 100).
|
Рис. 99. Микрофотографии РНП-компонентов ядра, полученные с помощью электронного микроскопа а — транскрипционные единицы диссоциированных ядрышек (по: Miller, Beathy, 1969); б — РНК-содержащие структуры в ядре печени крысы, окраска по Бернхарду (фото В.Ю. Полякова). ПХГ — перихроматиноные гранулы; ИХГ — интерхроматиновые гранулы; ЯК — ядрышки |
|
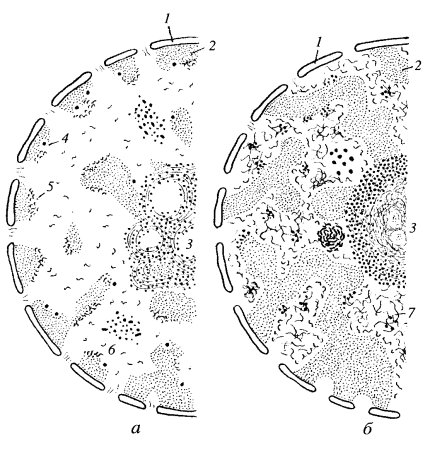
Рис. 100. Схема расположения РНП-продуктов в интерфазном ядре клетки животных (а) и в растениях с хромонемной организацией ядер (б) 1 — ядерная оболочка; 2 — хроматин; 3 — ядрышко; 4 — перихроматиновые гранулы; 5 — перихроматиновые фибриллы; 6 — интерхроматиновые гранулы; 7— гранулярно-фибриллярная сеть РНП |
Перихроматиновые фибриллы обнаруживаются по периферии участков конденсированного хроматина (околомембранного или любого другого). Они имеют толщину около 3-5 нм, часто образуют рыхлую неправильную сеть. Оказалось, что этот компонент ядра сильно изменяется при стимуляции синтеза РНК. Так, при возрастании синтеза РНК в клетках печени крыс после голодания и последующего питания или после введения кортизона адреналэктомированным животным зоны перихроматиновых фибрилл значительно увеличиваются. Эти зоны оказались наиболее активными по включению меченых предшественников в РНК, что было показано радиоавтографически с помощью электронного микроскопа. Такие фибриллы могут представлять новосинтезированную гяРНК.
Другой тип РНК-содержащих структур интерфазного ядра - перихроматиновые гранулы. Они имеют диаметр около 45 нм и окружены светлым ореолом. Эти гранулы встречаются только на периферии конденсированного хроматина, в диффузном хроматине их нет. Считается, что между этими гранулами и перихроматированными фибриллами существует структурная связь. При больших увеличениях внутри гранул можно видеть тонкие извитые фибриллы 3-5 нм толщиной.
Крупные гранулы типа перихроматиновых встречаются в специфических активных в отношении синтеза РНК участках политенных хромосом - в пуффах (см. далее). Сходные гранулы обнаружены в боковых петлях функционирующих мейотических хромосом. Исходя из этого, некоторые исследователи делают предположение, что такие рибонуклеопротеидные гранулы могут представлять собой зрелые комплексы из нескольких информофер - рибонуклеопротеидные частицы, содержащие информационную РНК. Однако это предположение нуждается в проверке.
Интерхроматиновые гранулы - третий тип РНК-содержащих структур. Они имеют размер 20-25 нм и группируются всегда в форме скоплений между участками хроматина. Эти гранулы не стандартны по величине и переплетены тонкими фибриллами.
В последнее время были получены антитела к мяРНП. Оказалось, что среди них есть и различные сплайсосомы - гранулы размером 20-30 нм. Эти мяРНП располагались в зонах, свободных от конденсированного хроматина, и по своей локализации совпадали с зонами, где располагались скопления интерхроматиновых гранул. Они могут представлять собой скопление сплайсосом, участвующих в конечных стадиях созревания гяРНК.
В таком случае всю картину динамики синтеза гяРНК можно представить следующим образом. Деконденсируюшиеся участки хроматина (эухроматин) по периферии конденсированных зон хроматина, связываясь с РНК-полимеразой II, транскрибируют гяРНК в виде начальных перихроматированных фибрилл, объединяющиеся с белками информофер, которые затем, подвергаясь созреванию с участием сплайсосом (интерхроматиновых гранул), дают начало зрелым формам иРНК - комплексам информофер, или перихроматиновым гранулам. Вероятно, не все зрелые иРНК могут переходить в крупные (45—60 нм) перихроматиновые гранулы, а последние, вероятно, характерны для РНК с высокой молекулярной массой.
Иную топографию в интерфазных ядрах имеют РНП-продукты растительных клеток. Так, в ядрах с хромонемной организацией интерфазного хроматина РНП в виде крупных гранул (20—30 нм) и тонких фибрилл (6-8 нм) располагается по периферии такого конденсированного хроматина и в межхроматиновых зонах; создается впечатление, что вся периферия хромонемных участков хроматина вовлечена в синтез РНК (см. рис. 100, б).
Были сделаны попытки изучить морфологию транскрипции нерибосомных генов на тотальных плоскостных препаратах. Для этого из гомогенатов ядер осаждали фракцию диффузного хроматина, обогащенного включенными мечеными предшественниками РНК. Активный хроматин на таких препаратах имел вид типичных нуклеосомных фибрилл с редко сидящими одиночными гранулами РНК-полимеразы, от которых отходили транскрипты РНК разной длины и конфигурации (рис. 101). Обычно это были изогнутые фибриллы, иногда имеющие на свободном конце глобулярные образования. Чаще всего расстояние между одиночными гранулами РНК-полимеразы доходило до 0,1—0,3 мкм, поэтому представлялось, что с гена транскрибируется лишь одна копия, в отличие от множественных копий, получаемых с генов рРНК. Однако в редких случаях обнаруживались участки хроматина с тесно расположенными РНК-полимеразами, от которых отходили в сторону транскрипты разной длины, образуя «елочкоподобные» структуры.
|
Рис. 101. Морфология транскрибирующихся участков интерфазного хроматина 1 — интенсивная транскрипция; 2 — слабая транскрипция |
Попытки наблюдать морфологию транскрипции на определенных генах были сделаны на целом ряде объектов, включая политенные хромосомы двукрылых насекомых и мейотические профазные хромосомы.

Синтез РНК в пуфах политенных хромосом
Более полные представления о морфологии синтеза и образования конечных продуктов транскрипции определенных генных участков интерфазных хромосом были получены при исследовании политенных хромосом.
Светооптическое изучение строения политенных хромосом двукрылых обнаружило, что кроме дисков и междисковых участков встречаются локальные расширения хромосом, так называемые пуфы. В этих участках ДНК не располагается в виде дисков, они имеют аморфную структуру, часто содержат РНК, базофильны. В пуфах происходит основное включение 3Н-уридина; это однозначно показывает, что они являются активными участками этих своеобразных интерфазных хромосом.
Количество пуфов и их локализация не являются постоянной характеристикой той или иной политенной хромосомы. Более того, рисунок пуфирования (т.е. расположение пуфов на хромосомах) на одной и той же хромосоме разный, в зависимости от стадии развития личинки или от типа клеток, взятых для исследования.
Так как возникновение пуфов прямо связывается с активацией синтеза РНК, то было показано, что развитие определенного пуфа отражает собой активацию отдельного или группы генов, детерминирующих функционально-метаболические особенности клеток на данном этапе развития. Поэтому в различных дифференцированных клетках картина пуффинирования не должна совпадать, что и наблюдается на самом деле (рис. 102).
|
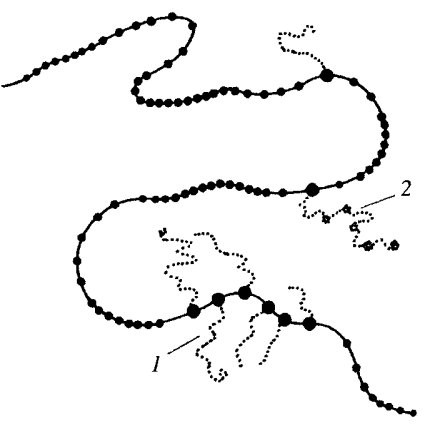
Рис. 102. Четвертая политенная хромосома личинки Chironomus dorsalis (слева) и куколки (справа) (по: Кикнадзе, 1985) Я — ядрышко; ЯОР — область ядрышкового организатора; КБI — пуф (кольцо Бальбиани I); КБII — пуф (кольцо Бальбиани II) |
При затухании синтеза РНК пуф начинает спадаться, уменьшаться в размерах, терять базофилию, и в конце концов на его месте можно видеть диск, из которого он развился. Особенно демонстративно это видно на особо крупных пуфах четвертой хромосомы Chironomus , которые носят название колец Бальбиани (КБ). Так, на личиночной стадии можно видеть на четвертой хромосоме вблизи от ядрышка два постоянных базофильных пуфа: КБ1 и КБ2.
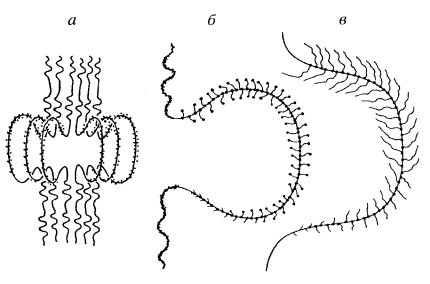
С помощью электронного микроскопа было обнаружено, что зона этих крупных пуфов содержит большое количество гранул рибонуклеопротеидной природы размером 50-60 нм. Эти гранулы, предположительно содержащие информационную РНК и соответствующие информосомам в составе кольца Бальбиани 2 (КБ2), располагаются особым образом. На ультратонких срезах можно наблюдать, что они располагаются рядами вдоль осевых элементов. Каждая гранула оказалась связанной с осевой структурой с помощью ножки-фибриллы толщиной 14-16 нм (рис. 103). Эта картина соответствует предположению, что гранулы размером 50-60 нм представляют собой РНП-продукты данного хромосомного локуса, находящиеся в процессе их синтеза. На плоскостных препаратах по Миллеру такие участки КБ2 были представлены многочисленными «елочкоподобными» структурами, состоящими из осевых компонентов и отходящих от них многочисленных гигантских траснкриптов, имеющих длину до 7,7 мкм. От участка транскрипции в данном случае отходит в среднем 123 гигантских транскрипта, связанных с комплексами РНК-полимеразы.
|
Рис. 103. Схема транскрипции в кольце Бальбиани II а — деконденсация хроматина с образованием транскрибирующихся участков ДНК в районе пуфа; б — транскрипционная единица на ультратонком срезе; в — она же на препаратах по Миллеру |
Расшифровка этих морфологических наблюдений стала возможной при анализе индивидуальных РНК, выделенных из КБ2. Для этого с помощью микроманипулятора выделяли ядра, затем отделяли от других четвертую хромосому и с помощью микродиссекции вырезали и накапливали зоны, содержащие КБ2. Затем из этих пуфов выделяли РНК, которую исследовали с помощью гель-электрофореза. Выделенная РНК оказалась огромных размеров, она имела молекулярную массу 15—35·106 Да и коэффициент седиментации 75S. Соответственно гены этой 75S РНК содержали 37 т.п.н. Вероятно, они не имеют интронов, так как 75S РНК не подвергается процессингу и служит матрицей для синтеза гигантских молекул секреторных белков. Гены 75S РНК оказались построены наподобие сателлитных ДНК: в их составе наблюдается иерархия внутренних повторов.
После завершения синтеза 75S РНК ее молекулы в виде крупных (50—60 нм) РНП-гранул транспортируются в цитоплазму. Однако значительная их часть разрушается: только 4—7% этой РНК обнаруживается в цитоплазме. Эти гигантские молекулы РНК образуют в цитоплазме особо крупные полисомы (700S), в состав которых входит 55—65 рибосом, на которых синтезируются длинные цепочки гликопротеидов клеток слюнной железы мотыля. (На самом деле эта железа не участвует в пищеварении, она не содержит ферментов; ее функция заключается в синтезе белка, необходимого личинке для построения домика и ловчих сетей.)

Транскрипция на мейотических хромосомах
Мейотические хромосомы типа «ламповых щеток» (см. далее) встречаются главным образом на стадии диплотены мейоза как у самцов, так и у самок. По сравнению с митотическими хромосомами мейотические хромосомы типа «ламповых щеток» намного длиннее и хорошо видны в световом микроскопе по двум причинам: они представляют собой спаренные и удвоенные хроматиды, так что в их состав входят четыре продольные субъединицы. Но отличительной особенностью этих хромосом является наличие боковых петель, отходящих от множества хромомеров, попарно симметрично располагающихся вдоль каждого гомолога (рис. 104). Именно в петлях хромосом типа «ламповых щеток» происходит синтез РНК во время длительной мейотической профазы.
|
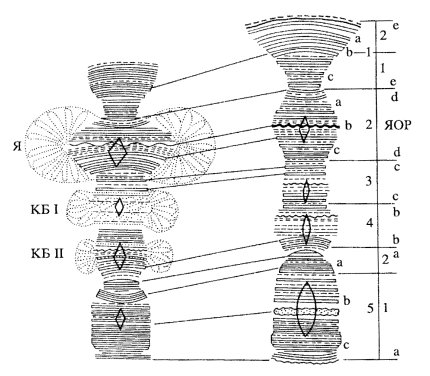
Рис. 104. Схема диплотенной хромосомы на стадии «ламповых щеток» а — бивалент с двумя хиазмами, парное расположение боковых петель; б — пара петель на сестринских хроматидах. Матрикс петли образован РНП-фибриллами - продуктами генной активности этих участков хромосом. Показаны два цистрона на каждой петле, отходящей от хромоцентра |
Следовательно, хромосомы типа «ламповых щеток» занимают как бы промежуточное положение между инактивированными максимально конденсированными хромосомами и активными интерфазными хромосомами: конденсированные участки хромомеров соответствуют участкам митотических хромосом, а боковые петли — участкам активных интерфазных хромосомных районов. Считается, что число боковых петель соответствует числу хромомеров, за исключением того, что хромомеры, представляющие центромерные участки, петель не несут. Так, у гребенчатого тритона, чьи хромосомы типа «ламповых щеток» особенно подробно изучены, насчитывается около 5 000 хромомеров на гаплоидный набор и соответственно 20 000 боковых петель на диплотенную митотическую хромосому (напомним, что в профазе мейоза клетки содержат тетраплоидное количество хроматид).
Латеральные, или боковые, петли в составе хромосом типа «ламповых щеток» неоднородны по своей структуре. Преобладают ординарные или нормальные петли длиной около 10 мкм. Они асимметричны по своей толщине: в световом микроскопе видно, что один из концов петли тонкий, а другой — толстый; развернутая петля имеет клиновидную форму. С помощью светового микроскопа в составе ординарных петель видно, что каждая петля покрыта как бы чехлом или матриксом, имеющим неясную гранулярно-фибриллярную структуру.
ДНК входит в состав осевого элемента петель и представляет собой основную хромосомную ДНК. Это доказывалось тем, что как боковые петли, так и осевые компоненты диплотенных хромосом рвутся при обработке ДНКазой.
Боковые петли способны к синтезу РНК: включение 3Н-уридина происходит практически во всех петлях по всей их длине. Новосинтезированная РНК в петлях быстро ассоциирует с белками, заранее синтезированными в цитоплазме.
При изучении ординарных петель на ультратонких срезах в их составе было найдено большое количество гранул величиной 25-40 нм, сходных с интер- и перихроматиновыми гранулами интерфазного ядра и с гранулами в пуфах политенных хромосом.
Более подробно структура боковых петель была изучена с помощью метода электронной микроскопии на препаратах распластанных диплотенных хромосом.
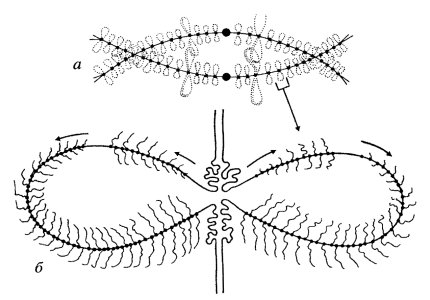
Оказалось, что общая морфология транскрипции на боковых петлях хромосом типа «ламповых щеток» удивительно напоминает таковую на рибосомных цистронах (см. рис. 104). Большинство ординарных боковых петель представляет собой одну транскрипционную единицу, начало транскрипции которой расположено на одном конце петли, а терминальный участок - на другом. Следовательно, такая транскрипционная единица тоже имеет форму «елочки», только изогнутой в виде петли. Здесь также наблюдается линейный градиент транскриптов: короткие в начале, а максимально длинные (до нескольких десятков нанометров) на концах транскрипционных единиц.
Транскрипты здесь представлены в виде рибонуклеопротеидов. В результате воздействия низких ионных сил они из глобул величиной 25-40 нм превращаются в вытянутые, изогнутые фибриллы, часто на конце имеющие утолщение. Морфология транскриптов на разных петлях неодинаковая. Встречаются расправленные, линейные фибриллы, а также кустистые фибриллы, многократно сложенные сами на себя, вероятно, в результате образования дуплексных структур РНК.
В некоторых петлях могут располагаться несколько транскрипционных единиц разной длины как с идентичной, так и с оппозитной ориентацией транскрипции (рис. 105). Интенсивность транскрипции также неодинакова на различных петлях: встречаются петли с 30 и с 3—5 транскриптами на 1 мкм.
|
Рис. 105. Схема ориентации транскрипционных единиц в петлях мейотических хромосом |
При падении транскрипционной активности в естественных условиях или при экспериментальном подавлении синтеза РНК длина петель уменьшается, они приобретают нуклеосомное строение.

Морфология транскрипции индивидуальных генов
Недавно был предложен более прогрессивный подход для исследования морфологии транскрипции индивидуальных структурных (кодирующих полипептидные цепи) генов. В эксперименте были использованы ооциты X . laevis , в ядра которых с помощью микроинъекций можно вводить любые молекулы, в том числе и ДНК. Если для такого введения взять клонированные гены, то, получая препараты по Миллеру, можно обнаружить отдельные от ядрышек и хромосом молекулы ДНК, которые в условиях высокой транскрипционной активности в ядрах ооцитов, в свою очередь, вовлекаются в процесс транскрипции. Это и дает возможность наблюдать за транскрипционной активностью индивидуального гена.
Так, в ядра ооцитов были инъецированы небольшие циклические молекулы клонированных генов овальбумина кур. Инъекция большого количества этих генов (2—5 нг на ядро) приводила к тому, что в ядре образовывались кластеры из нескольких сотен циклических молекул, хорошо отличающихся от элементов собственного хроматина ооцитов. Оказалось, что 80-90% инъецированного материала неактивны. В этом случае индивидуальные циклические молекулы генов были сплошь покрыты нуклеосомами и не содержали транскрипционных комплексов (РНК-полимераза вместе с цепочкой синтезированной РНК).
Небольшая часть инъецированных генов, однако, обладала типичными транскрипционными комплексами. Среди таких активированных генов встречаются, по крайней мере, три морфологических класса. В первом случае это были циркулярные молекулы со слабой транскрипцией (3—10 транскриптов на 1 мкм длины хроматина), транскрипты были разной длины и не обладали линейным градиентом. В другом случае наблюдали интенсивно транскрибируемые циклические участки хроматина, покрытые транскрипционными комплексами по всей длине молекулы ДНК (30—50 транскриптов на 1 мкм хроматина). Здесь транскрипты достигали длины до 1,2 мкм. РНК на интенсивно транскрибируемых участках всегда была расположена по градиенту длины, образуя участки, напоминающие «елочки» на транскрипционных единицах ядрышковых ДНК. Первичный транскрипт с клонированного гена овальбумина кур содержит участки кодирующих последовательностей (экзоны) и интроны. На подобных препаратах в тесной ассоциации с нитчатыми транскриптами бывают видны также глобулярные сплайсосомы. Таким образом удается наблюдать за работой любых индивидуальных генов.

Синтез транспортных РНК
Гены транспортных РНК относятся к умеренно повторяющимся (10—100) последовательностям в геноме. Они, так же как р-гены, располагаются тандемно. Длина разных (31 шт.) тРНК колеблется от 74 до 95 нуклеотидов (примерно 30 нм), уложенных в сложную трехмерную фигуру. Отдельный ген тРНК состоит из двух крайних экзонов и одного центрального интрона. Во время процессинга интрон удаляется, а два экзона с помощью фермента лигазы соединяются в зрелую молекулу.

Величко В.В. © Copyright 2008.![]()
![]()