О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИ
МОРФОЛОГИЯ ЯДЕРНЫХ СТРУКТУР
ХРОМОНЕМНЫЙ (ЧЕТВЕРТЫЙ) УРОВЕНЬ УПАКОВКИ ХРОМАТИНА
НЕРИБОСОМНЫЕ ПРОДУКТЫ КЛЕТОЧНОГО ЯДРА
ЯДЕРНАЯ ОБОЛОЧКА

Роль ядерных структур в жизнедеятельности клетки
Приведенный в предыдущем разделе краткий обзор основных процессов, связанных с синтезом белка, в принципе одинаковых у всех форм живого, указывает на особое значение клеточного ядра. Ядро осуществляет две группы общих функций: одна из них — хранение генетической информации, другая — ее реализация, обеспечение синтеза белка.
В первую группу входят процессы, обусловливающие поддержание наследственной информации в виде неизменной структуры ДНК. Эти процессы связаны с наличием так называемых репарационных ферментов, ликвидирующих спонтанные повреждения молекулы ДНК (разрыв одной из цепей ДНК, часть радиационных повреждений), что сохраняет строение молекул ДНК практически неизменным в ряду поколений клеток или организмов. Далее в ядре происходят воспроизведение, или редупликация, и разъединение (сегрегация) молекул ДНК, что дает возможность двум клеткам получить совершенно одинаковые и в качественном и количественном смысле объемы генетической информации. В ядре эукариот происходят процессы изменения и рекомбинации генетического материала, что наблюдается во время мейоза (кроссинговер). Наконец, ядра непосредственно участвуют в процессах распределения молекул ДНК при делении клеток.
Другой группой клеточных процессов, обеспечивающихся активностью ядра, является создание собственного аппарата белкового синтеза. Это не только синтез (транскрипция) на молекулах ДНК разных информационных РНК, но также транскрипция всех видов трансферных РНК и рибосомных РНК. В ядрах эукариотических клеток происходит «созревание» (процессинг, сплайсинг) первичных транскриптов. В ядре эукариот образуются также субъединицы рибосом путем комплексирования синтезированных в ядрышке рибосомных РНК с рибосомными белками, которые синтезируются в цитоплазме и переносятся в ядро. Таким образом, ядро представляет собой не только вместилище генетического материала, но и структуру, где этот материал воспроизводится и функционирует. Поэтому выпадение или нарушение любой из перечисленных выше функций гибельно для клетки в целом. Так, нарушение репарационных процессов приведет к изменению первичной структуры ДНК и автоматически к изменению структуры белков. Это непременно скажется на их специфической активности, которая может просто исчезнуть или измениться так, что не будет обеспечивать клеточные функции, в результате чего клетка погибает. Нарушения редупликации ДНК приведут к остановке размножения клеток или к появлению клеток с неполноценным набором генетической информации, что тоже гибельно для клеток. Такой же результат будет наблюдаться при нарушении процессов распределения генетического материала (молекул ДНК) при делении клеток. Выпадение в результате поражения ядра или в случае нарушений каких-либо регуляторных процессов синтеза любой формы РНК автоматически приведет к остановке синтеза белка в клетке или к грубым его нарушениям.
Все это указывает на ведущее значение ядерных структур в процессах, связанных с синтезом нуклеиновых кислот и белков - основных функционеров в жизнедеятельности клетки.
Необходимо еще раз подчеркнуть, что функционирование ядра как системы хранения и реализации генетической информации неразрывно связано с другими функциональными системами клетки, которые обеспечивают работу ядра специальными белками, потоком предшественников, энергией и пр.

Ядерные компоненты прокариот
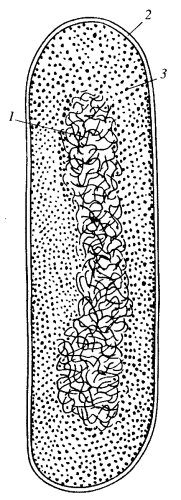
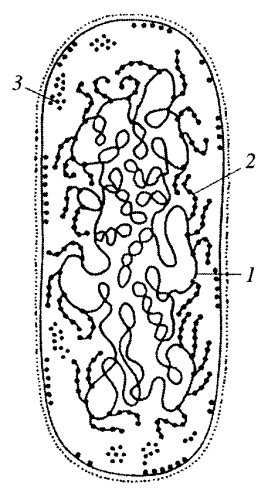
Как уже говорилось, клетки царства прокариотических, или «доядерных», организмов не имеют обособленного клеточного ядра. Однако у всех прокариотических клеток есть аналог ядра эукариот, который носит название нуклеоид, или нуклеоплазма. Нуклеоид прокариот можно отнести к собственно ядерным структурам из-за того, что он содержит ДНК. Нуклеоид достаточно четко выявляется при световой микроскопии после специфической окраски на ДНК по методу Фёльгена или при окраске флуорохромами. Его можно наблюдать и с помощью фазово-контрастного устройства у крупных бактерий или синезеленых водорослей как темное и более контрастное образование в срединной части клетки. На ультратонких срезах зона нуклеоида представлена тонкими рыхлыми сетями фибрилл толщиной 2-7 нм (рис. 1 и 20). Эта зона нуклеоида, или нуклеоплазмы, на ультратонких срезах свободна от других структур и выглядит более светлой по сравнению с окружающей цитоплазмой, заполненной рибосомами, различными гранулами и мембранами. Иногда на срезах можно наблюдать контакты фибрилл нуклеоида с плазматической мембраной, с ее выростами. Нуклеоиды бактерий можно выделить, их состав и структура изучены довольно подробно. Они на 80% состоят из ДНК, остальные 20% приходятся на различные белки и РНК.
|
Рис. 20. Бактериальный нуклеоид на срезе клетки Propionibacterium shermanii 1 — нуклеоид; 2 — плазматическая мембрана; 3 — рибосомы |
Количество ДНК в прокариотических клетках значительно меньше, чем в клетках эукариот. Например, бактерия Е. coli содержит 5·103 пг ДНК, которая кодирует около 2000 генов, в то время как в ядре клетки человека содержится около 6 пг ДНК, что соответствует огромному (105) числу генов. (Единицы измерения ДНК: пг — 1·1012 г, Да — 1,67-24 г. Расстояние между нуклеотидными парами равно ~0,34 нм.)
При анализе радиоавтографов меченых молекул ДНК в световом микроскопе было обнаружено, что бактериальные ДНК имеют кольцевую структуру. У Е. coli периметр такого кольца составляет около 1,6 мм. Считается, что на клетку приходится одна гигантская циклическая молекула ДНК, одна бактериальная хромосома, или генофор, с молекулярной массой 4·109 Да. Самая маленькая бактериальная хромосома обнаружена в клетках микоплазмы — 0,25 мм (для сравнения, длина ДНК на одну хромосому эукариотической дрожжевой клетки составляет около 4,6 мм, а у человека — 40 мм (!)).
У ряда бактерий, например у В. subtilis, имеется от двух до девяти одинаковых молекул ДНК и соответственно несколько нуклеоидов. В других случаях (Azotobacter vinelandii) около 40 хромосом организованы в один нуклеоид.
С помощью радиоавтографической методики также обнаружено, что репликация такой кольцевой хромосомы у Е. coli начинается на одной исходной (origin) точке репликации, при этом образуются две репликационные вилки, которые по мере синтеза ДНК движутся вдоль молекулы до терминальной, конечной точки (рис. 21). Вся такая гигантская молекула ДНК представляет единицу репликации - репликон. Скорость репликации у бактерий составляет около 30 мкм в минуту, что согласуется со временем удвоения клеток, равным около 40 мин.
|
Рис. 21. Репликация хромосомы Е. coli 1 — исходная ДНК кольцевой хромосомы; 2, 3 — вилки репликации; 4 — вновь синтезированные участки |
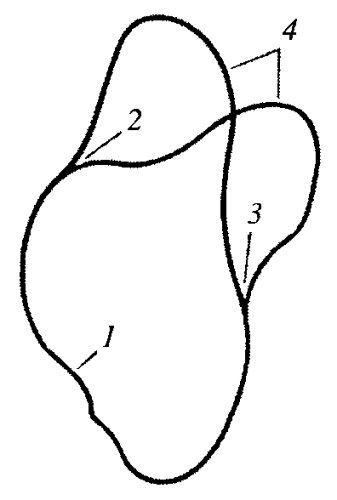
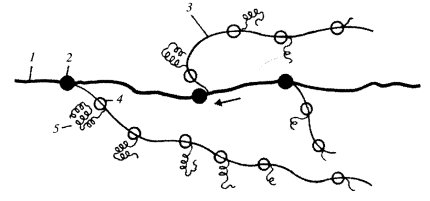
Бактериальные хромосомы всегда связаны с плазматической мембраной через специфические мембранные белки, которые взаимодействуют с ДНК в зоне старта ее синтеза (рис. 22). В процессе клеточного деления существенных изменений в компактности нуклеоплазмы не наблюдается, в отличие от эукариотических хромосом.
|
Рис. 22. Связь хромосомы бактериальной клетки с плазматической мембраной Хромосома связывается с мембраной в точке начала репликации в течение всего клеточного цикла. 1 — ДНК хромосомы (нуклеоида); 2 — точки начала репликации |
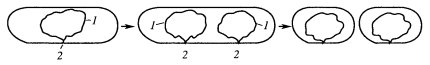
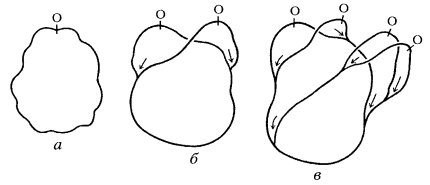
Такие кольцевые молекулы ДНК бактерий были получены при полном удалении белков (депротеинизация). Если же изучать выделенные целые нуклеоиды бактерий, то они представляют собой тела, состоящие из многочисленных суперспирализованных петель ДНК, отходящих от плотной центральной области (рис. 23). В одну такую петлю, или домен, входит до 10—15 мкм ДНК, или около 40 000 п.н., а всего таких петель около 120.
|
Рис. 23. Модель конденсации бактериальной хромосомы (Зенгбуш, 1982) а — кольцевая хромосома; б — белковые сшивки образуют петлевые домены; в — сверхспирализация доменов; г и д — различные формы деконденсации нуклеоида |
Обработка выделенных нуклеоидов РНКазой и протеолитическими ферментами приводит к разрыхлению центральной области нуклеоидов, а короткая обработка ДНКазой — к снятию сверхспирализации петель и декомпактизации всего нуклеоида. Таким образом, было показано, что компактизация нуклеоида связана с наличием связок, содержащих РНК и некоторые белки. Гигантская кольцевая молекула - хромосома — с помошью РНК и белков многократно складывается, образуя многочисленные петли, ДНК которых подвергается сверхспирализации, что приводит к значительной компактизации всего комплекса, который и представляет собой нуклеоид. Степень компактизации ДНК в нуклеоиде бактерий достигает 1000 крат, а концентрация ДНК доходит до 10 мг/мл (!). Необходимо подчеркнуть, что часть ДНК нуклеоида связана с небольшим числом специальных основных белков, отличных от гистонов эукариот. Одна молекула одного из таких белков (H-NS) приходится на 400 п.н. ДНК. С петлями ДНК нуклеоида связано большое число молекул различных синтезируемых РНК и рибосом, которые обнаруживаются по периферии нуклеоплазмы.
Одна из моделей организации нуклеоида предполагает, что центральная его часть представлена неактивной и сверхспирализованной ДНК, тогда как по его периферии расположены деспирализованные петли, на которых происходит синтез различных РНК (рис. 24).
|
Рис. 24. Схема организации нуклеоида бактериальной клетки 1 — петлевые домены ДНК; 2 — рибосомы на вновь синтезированных молекулах иРНК; 3 — рибосомы цитоплазмы |
Отличительной чертой ядерных структур прокариот является то, что у них синтез РНК и синтез белка могут происходить одновременно: рибосомы связываются с еще не до конца синтезированными молекулами иРНК и производят на них синтез белка. Таким образом, возникает тройственный синтетический комплекс: ДНК - синтезирующая цепь РНК - рибосомы с синтезируемой полипептидной цепочкой (рис. 25). Такая ситуация возможна лишь в том случае, когда образующаяся молекула иРНК не подвергается дальнейшей модификации типа процессинга, характерного для эукариотических клеток (см. далее). У прокариот, таким образом, процессы транскрипции и трансляции не разобщены территориально, в то время как у эукариотических клеток эти процессы протекают в двух разных компартментах, разделенных специальной ядерной оболочкой.
|
Рис. 25. Одновременная транскрипция иРНК и синтеза белка на участке бактериального нуклеоида 1 — ДНК; 2 — РНК-полимераза; 3 — иРНК; 4 — рибосома; 5 — полипептид |
При делении клетки и в течение клеточного цикла поведение ядерного материала прокариот отличается от такового эукариот.
Клеточный цикл — это время существования клетки отделения до деления. Как уже указывалось, деление всех типов клеток происходит только после удвоения ДНК. У бактерий часто сам процесс разделения тела клетки — цитотомия — не связан с окончанием синтеза ДНК, так как до наступления клеточного деления может начаться второй или даже третий раунд репликации ДНК. В результате такого беспрерывного синтеза ДНК в быстро растущих культурах на каждую разделившуюся клетку приходится одна кольцевая хромосома, находящаяся на промежуточных стадиях ее дальнейшего удвоения (рис. 26), т.е. каждая дочерняя клетка сразу после деления уже содержит частично реплицированный геном.
|
Рис. 26. Повторная репликация бактериальной хромосомы при интенсивном размножении клеток а — исходная хромосома; 6 — частично реплицированная хромосома (I раунд репликации): в — инициация синтеза ДНК во II раунде репликации; О — точки начала репликации (ori). Стрелки указывают на репликационные вилки |
При делении бактериальных клеток не происходит особой конденсации ДНК в составе нуклеоида. По мере роста клетки в длину зона нуклеоида после синтеза ДНК увеличивается, а затем делится с помощью специального механизма. Обособление и разъединение двух дочерних хромосом связано с расхождением мест прикрепления хромосом к плазматической мембране (см. далее).

Ядро эукариотических клеток
Термин «ядро» впервые был применен Брауном в 1833 г. для обозначения шаровидных постоянных структур в клетках растений. Позднее такую же структуру описали во всех клетках высших организмов.
Ядерный аппарат эукариотических клеток имеет ряд отличий от прокариотических. Во-первых, ДНК-содержащий компонент отделен от цитоплазмы специальной оболочкой (ядерная оболочка), во-вторых, количество ДНК в ядрах эукариот в тысячи раз больше, чем в составе нуклеоидов бактерий, в-третьих, ДНК эукариот представляет собой сложный нуклеопротеидный комплекс, образующий специальную структуру - хроматин, из которого и состоят эукариотические хромосомы. Далее, в состав ядер эукариот входят несколько физически не связанных хромосом, каждая из которых содержит одну линейную гигантскую молекулу ДНК. Каждая хромосомная ДНК представляет собой полирепликонную структуру, т.е. содержит множеств автономно реплицирующихся участков. Синтез и образование транскриптов эукариотических клеток сопровождаются процессами вторичной их перестройки, «созревания», включающей в себя как фрагментацию (процессинг), так и сращивание отдельных фрагментов ДНК (сплайсинг). Наконец, в ядрах не происходит синтеза белков, т.е. в эукариотических клетках процессы синтеза ДНК и РНК разобщены от процесса синтеза белков.
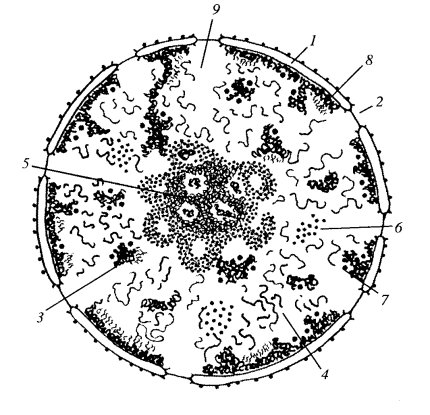
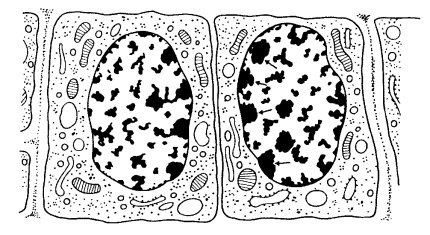
Клеточное ядро, обычно одно на клетку (есть примеры многоядерных клеток), состоит из ядерной оболочки, отделяющей его от цитоплазмы, хроматина, ядрышка и других продуктов синтетической активности, ядерного белкового остова (матрикса) и кариоплазмы (или ядерного сока) (рис. 27). Эти основные компоненты встречаются практически во всех неделящихся клетках эукариотических одно- или многоклеточных организмов.
|
Рис. 27. Схема строения клеточного ядра 1 — ядерная оболочка (две мембраны - внутренняя и внешняя, и перинуклеарное пространство); 2 — ядерная пора; 3 — конденсированный хроматин; 4 — диффузный хроматин; 5 — ядрышко (гранулярный и фибриллярный компоненты, в центральных светлых зонах находится рДНК); 6 — интерхроматиновые гранулы (РНП); 7 — перихроматиновые гранулы (РНП); 8 — перихроматиновые фибриллы (РНП); 9 — кариоплазма, ядерный сок |
Главный компонент ядер — хроматин, является структурой, выполняющей генетическую функцию клетки, в хроматиновой ДНК заложена практически вся генетическая информация. Ядерная оболочка выполняет сложную барьерно-рецепторную, а также транспортную и каркасную функции. Нехроматиновый ядерный белковый остов (матрикс) обеспечивает не только пространственное расположение хромосом в ядре, но и участвует в их функциональной активности. Одним из хромосомных участков, определяющих синтез рРНК и образование клеточных рибосом, является ядрышко. Кроме того, в ядре наряду с хроматином и матриксом обнаруживаются различные рибонуклеопротеидные структуры, содержащие разные типы РНК. Между всеми этими компонентами заключена жидкая фаза клеточного ядра - кариоплазма, в которой протекают многие процессы, связанные как с ядерным метаболизмом, так и с внутриядерным транспортом белков и РНК.
При наблюдении многих живых клеток, особенно растительных, или же клеток после фиксации и окраски внутри ядра выявляются зоны плотного вещества, которое хорошо окрашиваются разными красителями, особенно основными. Благодаря этому свойству выявленный компонент ядра получил название «хроматин» (Флемминг, 1880). Способность хроматина воспринимать основные (щелочные) красители указывает на его кислотные свойства, которые определяются тем, что в состав хроматина входит ДНК в комплексе с белками. Такими же свойствами окрашиваемости и содержанием ДНК обладают и хромосомы, которые можно наблюдать во время митотического деления клеток.
В отличие от прокариотических клеток ДНК-содержащий материал хроматина эукариот может пребывать в двух альтернативных состояниях: деконденсированном в интерфазе и в максимально уплотненном во время митоза, в составе митотических хромосом.
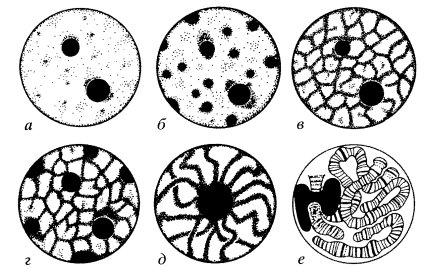
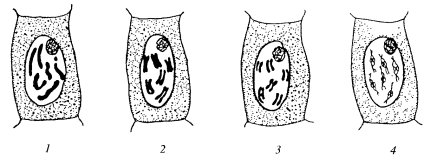
В неделящихся (интерфазных) клетках хроматин, выявляемый с помощью светового микроскопа, может равномерно заполнять объем ядра или же располагаться отдельными сгустками (хромоцентры). Нередко он особенно четко обнаруживается на периферии ядра (пристеночный, маргинальный, примембранный хроматин) или образует внутри ядра переплетения довольно толстых (около 0,3 мкм) и длинных тяжей в виде внутриядерной сети. Такие ядра часто встречаются в клетках растений (рис. 28—30).
|
Рис. 28. Структурные типы ядер а — диффузный; б — хромоцентрический; в — хромонемный; г — хромонемно-хромоцентрический; д — хромосомный; е — ядро с политенными хромосомами |
|
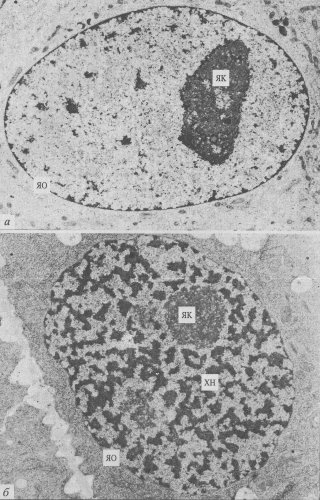
Рис. 29. Ультраструктура интерфазных ядер а — ядро диффузного типа (клетка культуры ткани почек); б — ядро хромонемного типа (корешок проростка лука). ЯК — ядрышко; ЯО — ядерная оболочка; ХН — хромонема |
|
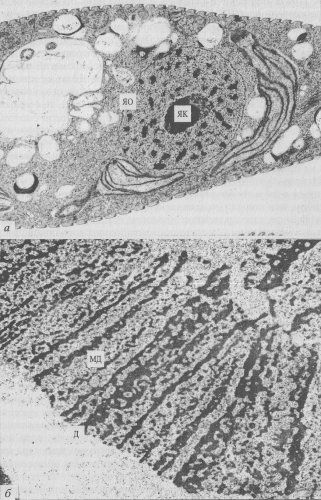
Рис. 30. Ультраструктура интерфазных ядер а — ультратонкий срез хромосомного ядра эвглены; б — фрагмент гигантской политенной хромосомы ядра слюнной железы хирономуса. ЯК — ядрышко; ЯО — ядерная оболочка; Д — хроматиновые диски; МД — междисковые участки хромосом |
Хроматин интерфазных ядер представляет собой несущие ДНК тельца (хромосомы), которые теряют в это время свою компактную форму, разрыхляются, деконденсируются. Степень такой деконденсации хромосом может быть различной в ядрах разных клеток. Когда хромосома или ее участок полностью деконденсированы, эти зоны называют диффузным хроматином. При неполном разрыхлении хромосом в интерфазном ядре видны участки конденсированного хроматина (иногда называемого гетерохроматином). Многочисленными работами показано, что степень деконденсации хромосомного материала — хроматина, в интерфазе может отражать функциональную нагрузку этой структуры. Чем более диффузен хроматин интерфазного ядра, тем выше в нем синтетические процессы. Так, в клетках лимфоцитов хроматин образует значительные скопления по периферии клеточного ядра. При стимуляции этих клеток к синтезу ДНК по мере включения предшественника ДНК 3Н-тимидина происходит постепенная деконденсация хроматина. Таким же образом меняется структура хроматина при синтезе РНК. Падение синтеза ДНК и РНК в клетках обычно сопровождается увеличением зон конденсированного хроматина. В эритроцитах низших позвоночных практически весь хроматин ядер находится в конденсированном состоянии, и в этих ядрах не происходит синтеза ни РНК, ни ДНК. Если же ядра этих клеток стимулировать к синтезу РНК, например в гетерокарионах (см. далее), то они переходят в диффузное состояние.
Максимально конденсирован хроматин во время митотического деления клеток, когда он обнаруживается в виде телец — хромосом. В этот период хромосомы не несут никаких синтетических нагрузок, в них не происходит включения предшественников ДНК и РНК.
Исходя из этого, можно считать, что хромосомы клеток могут находиться в двух структурно-функциональных состояниях: в рабочем, частично или полностью деконденсированном, когда с их участием в интерфазном ядре происходят процессы транскрипции и редупликации, и в неактивном - в состоянии метаболического покоя при максимальной их конденсации, когда они выполняют функцию распределения и переноса генетического материала в дочерние клетки.

Эухроматин и гетерохроматин
Многими исследователями было отмечено, что степень структуризации, конденсации хроматина в интерфазных ядрах может быть выражена в разной мере. Так, в интенсивно делящихся и в мало специализированных клетках ядра имеют диффузную структуру, в них кроме узкого периферического ободка конденсированного хроматина встречается небольшое число мелких хромоцентров, основная же часть ядра занята диффузным, деконденсированным хроматином. В то же время в высокоспециализированных клетках или в клетках, заканчивающих свой жизненный цикл, хроматин представлен в виде массивного периферического слоя и крупных хромоцентров, блоков конденсированного хроматина. Такую структуру имеют, например, ядра нормобластов (одна из стадий дифференцировки эритроцитов), ядра зрелых лейкоцитов. Эти два примера могут иллюстрировать общее правило: чем больше в ядре доля конденсированного хроматина, тем меньше метаболическая активность ядра. При естественной или экспериментальной инактивации ядер происходит прогрессивная конденсация хроматина и, наоборот, при активации ядер увеличивается доля диффузного хроматина.
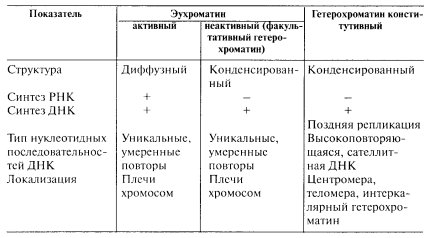
Однако при метаболической активации не всякие участки конденсированного хроматина могут переходить в диффузную форму. Еще в начале 1930-х годов Э. Гейтцем было замечено, что в интерфазных ядрах существуют постоянные участки конденсированного хроматина, наличие которого не зависит от степени дифференцированности ткани или от функциональной активности клеток. Такие участки получили название гетерохроматина, в отличие от остальной массы хроматина - эухроматина (собственно хроматина). По этим представлениям, гетерохроматин - компактные участки хромосом, которые в профазе появляются раньше других частей в составе митотических хромосом и в телофазе не деконденсируются, переходя в интерфазное ядро в виде интенсивно красящихся плотных структур (хромоцентров). Первоначально понятие гетерохроматина имело сугубо морфологическое значение, потому что при изучении препаратов окрашенных ядер нельзя знать, может ли данный участок конденсированного хроматина — хромоцентр — перейти в будущем в разрыхленное, эухроматическое состояние или нет. В связи с этим в специальной цитологической литературе часто без всякого основания любой участок конденсированного хроматина стали называть гетерохроматином. Процесс общей конденсации хроматина, например в ядрах лейкоцитов, называли гетерохроматизацией ядер. На самом же деле в составе ядерного хроматина только лишь некоторые участки практически никогда не теряют особого конденсированного состояния. Такими постоянно конденсированными зонами чаще всего являются центромерные и теломерные участки хромосом. Кроме них постоянно конденсированными могут быть некоторые участки, входящие в состав плечей хромосом — вставочный, или интеркалярный, гетерохроматин, который в ядрах также представлен в виде хромоцентров. Такие постоянно конденсированные участки хромосом в интерфазных ядрах сейчас принято называть конститутивным (постоянным) гетерохроматином. Необходимо отметить, что участки конститутивного гетерохроматина обладают целым рядом особенностей, которые отличают его от остального хроматина. Конститутивный гетерохроматин генетически не активен; он не транскрибируется, реплицируется позже всего остального хроматина, в его состав входит особая (сателлитная) ДНК, обогащенная высокоповторяющимися последовательностями нуклеотидов (см. далее); он локализован в центромерных, теломерных и интеркалярных зонах митотических хромосом. Доля конститутивного хроматина может быть неодинаковой у разных объектов. Так, у млекопитающих на его долю приходится 10-15% всего генома, а у некоторых амфибий - даже до 60%. Функциональное значение конститутивного гетерохроматина до конца не выяснено. Предполагается, что он несет ряд важных функций, связанных со спариванием гомологов в мейозе, со структуризацией интерфазного ядра, с некоторыми регуляторными функциями.
Вся остальная, основная масса хроматина ядра может менять степень своей компактизации в зависимости от функциональной активности, она относится к эухроматину. Эухроматические неактивные участки, которые находятся в конденсированном состоянии, стали называть факультативным гетерохроматином, подчеркивая необязательность такого его состояния. Хорошим примером факультативного гетерохроматина может служить Х-хромосома в организме человека. В клетках мужской особи Х-хромосома деконденсирована, она активна, транскрибируется и морфологически не выявляется из-за своего рыхлого, диффузного состояния. В клетках женского организма, где присутствуют две Х-хромосомы, одна из них находится в активном, диффузном состоянии, а вторая - в неактивном, конденсированном и временно гетерохроматизована. В этом состоянии она может существовать в течение всей жизни организма. Но потомки ее, попадая в клетки мужского организма следующего поколения, снова будут активированы.
В дифференцированных клетках всего лишь около 10% генов находится в активном состоянии, остальные гены инактивированы и входят в состав конденсированного хроматина (факультативный гетерохроматин). Это обстоятельство объясняет, почему большая часть хроматина ядра структурирована (табл. 1).
Таблица 1 |
Сравнительные характеристики эухроматических и гетерохроматических районов интерфазных хромосом |
|

Хромосомный цикл
Как известно, половые женские и мужские клетки несут одинарный набор хромосом и, следовательно, содержат в 2 раза меньше ДНК, чем все остальные клетки организма. Половые клетки (сперматозоиды и ооциты) с одинарным набором хромосом называют гаплоидными. Плоидность (от греч. ploos — кратность) обозначают буквой n. Так, клетки с 1n — гаплоидны, с 2n — диплоидны, с Зn — триплоидны и т.д. Соответственно количество ДНК на клетку (с) зависит от ее плоидности: клетки с числом хромосом 2n содержат 2с количества ДНК. При оплодотворении происходит слияние двух клеток, каждая из которых несет 1n набор хромосом, поэтому образуется исходная диплоидная (2n, 2с) клетка — зигота. В дальнейшем в результате деления диплоидной зиготы и последующего деления диплоидных клеток разовьется организм, клетки которого, кроме половых, будут диплоидными.
Однако мы знаем, что процессу деления клеток предшествует фаза синтеза - редупликации ДНК, что должно приводить к появлению клеток с количеством ДНК 4с, у которых количество хромосом 4n, т.е. в два раза больше, чем у исходной диплоидной клетки. И только после деления такой тетраплоидной (4с) клетки снова возникнут две исходные диплоидные клетки.
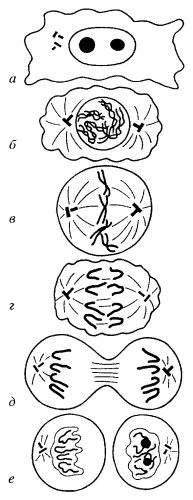
В ядрах интерфазных клеток выявить тела хромосом с помощью морфологических методов очень трудно. Собственно хромосомы как четкие, плотные, хорошо видимые в световой микроскоп тела выявляются только незадолго до клеточного деления. В самой же интерфазе хромосом как плотных тел не видно, так как они находятся в разрыхленном состоянии. В интерфазе происходит удвоение, редупликация хромосом. Этот период характеризуется синтезом ДНК, он называется синтетическим, или S-периодом. Как раз в это время в клетках обнаруживается количество ДНК большее, чем 2с. После окончания S-пeриода количество ДНК в интерфазном ядре равно 4с, ибо произошло полное удвоение хромосомного материала. Однако микроскопически регистрировать удвоение числа хромосом на этой стадии не всегда удается. Собственно хромосомы как нитевидные плотные тела начинают обнаруживаться микроскопически в начале процесса деления клетки, а именно в профазе митотического деления клетки (рис. 31). Если попытаться подсчитать число хромосом в профазе, то их количество будет равно 2n. Но это ложное впечатление, потому что в профазе каждая из хромосом двойная в результате их редупликации. На этой стадии пара хромосом тесно соприкасается друг с другом, взаимно спирализуясь одна относительно другой, поэтому трудно увидеть двойственность всей структуры в целом. Позднее хромосомы в каждой паре начинают обосабливаться, раскручиваться. Такая двойственность хромосом в митозе наблюдается даже у живых клеток в конце профазы, когда видно, что общее число хромосом в такой начинающей делиться клетке равно 4n. Следовательно, уже в начале профазы хромосомы состоят из двух сестринских хромосом, или, как их еще называют, хроматид.
|
Рис. 31. Схема стадий митотического деления клетки а — интерфаза; б — профаза; в — метафаза; г — анафаза; д — ранняя телофаза; е — поздняя телофаза, начало реконструкции ядер |
И в профазе, и в следующем периоде деления клетки — в метафазе — сестринские хромосомы остаются связанными друг с другом в виде пары. В метафазе происходит выстраивание хромосом в экваториальной плоскости клетки и окончательное их разъединение. И в профазе и в метафазе клетки остаются тетраплоидными.
В анафазе идет расхождение каждой из хромосом данной пары к противоположным полюсам клетки, после чего тело исходной клетки начинает делиться. Затем в телофазе разошедшиеся диплоидные (2n) наборы хромосом начинают деконденсироваться. Отдельные хромосомы теряют свои четкие очертания, и теперь уже внутри нового интерфазного диплоидного ядра с 2с ДНК трудно узнать хромосомы, которые мы могли видеть во время митоза. Так заканчивается один хромосомный цикл и начинается следующий.

Общая морфология митотических хромосом
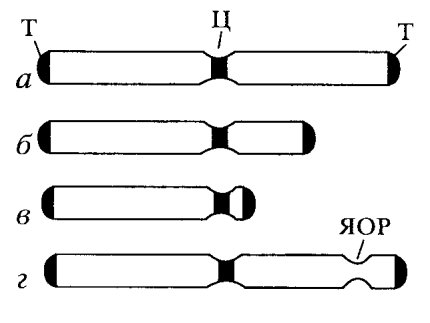
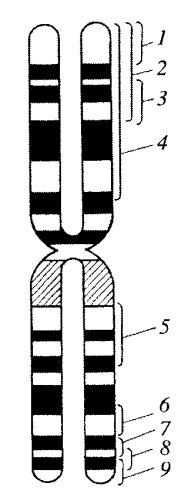
Хромосомы всех эукариотических клеток построены по одному плану. Они включают в себя три основных компонента: собственно тело хромосомы (плечо), теломерный, конечный участок и центромеру. Наиболее просто устроены хромосомы дрожжевых клеток: палочковидное тело хромосомы на одном конце имеет теломеру, а на другом — центромеру. Хромосомы животных и растений также представляют собой палочковидные структуры разной длины с довольно постоянной толщиной, но обычно имеют два хромосомных плеча, соединенных в зоне центромеры. Эта зона называется первичной перетяжкой. Соответственно оба плеча хромосомы оканчиваются теломерами (рис. 32). Хромосомы с равными или почти равными плечами называют метацентрическими, с плечами неодинаковой длины — субметацентрическими, палочковидные хромосомы с очень коротким, почти незаметным вторым плечом — акроцентрическими.
|
Рис. 32. Схема морфологии метацентрических (а), субметацентрических (б), акроцентрических (телоцентрических) (в) и спутничных (ядрышковых) (г) хромосом Т — теломеры; Ц — центромеры (первичные перетяжки); ЯОР — ядрышковый организатор (вторичная перетяжка) |
В области первичной перетяжки (центромеры) расположен кинетохор — пластинчатая структура, имеющая форму диска. К нему подходят пучки микротрубочек митотического веретена, идущие в направлении к центриолям. Эти пучки микротрубочек принимают участие в движении хромосом к полюсам клетки при митозе.
Обычно каждая хромосома имеет только одну центромеру (моноцентрические хромосомы), но могут встречаться хромосомы дицентрические и полицентрические, т.е. обладающие множественными кинетохорами.
В зоне первичной перетяжки присутствует особая, центромерная, сателлитная ДНК, отличающаяся высоким уровнем повторенности нуклеотидных последовательностей.
Некоторые хромосомы имеют вторичную перетяжку. Последняя обычно расположена вблизи дистального конца хромосомы и отделяет маленький участок - спутник. Вторичные перетяжки называют еще и ядрышковыми организаторами, так как именно на этих участках хромосом в интерфазе происходит образование ядрышка. Здесь же локализована ДНК, ответственная за синтез рРНК. В хромосомах человека ядрышковые организаторы расположены в коротких плечах вблизи центромер.
Плечи хромосом оканчиваются конечными участками — теломерами. Теломерные концы хромосом не способны соединяться с другими хромосомами или их фрагментами, в отличие от концов хромосом, лишенных теломерных участков (в результате разрывов), которые могут присоединяться к таким же разорванным концам других хромосом. В теломерах локализована особая теломерная ДНК, защищающая хромосому от укорачивания в процессе синтеза ДНК.
Размеры хромосом у разных организмов варьируют в широких пределах (рис. 33). Так, длина хромосом может колебаться от 0,2 до 50 мкм. Самые мелкие хромосомы отмечены у некоторых простейших, грибов, водорослей; очень мелкие хромосомы - у льна и морского камыша; они настолько малы, что с трудом видны в световом микроскопе. Наиболее длинные хромосомы обнаружены у некоторых прямокрылых насекомых, у амфибий и у лилейных. Длина хромосом человека находится в пределах 1,5—10 мкм.
|
Рис. 33. Хромосомы разных видов животных (Мюнцинг, 1963) а — речной рак (2n=196); б — комар Culex (2n=6); в — щука (2n=18); г — курица; д — кошка (2n=38); е — лошадь (2n=66); ж — бык (2n=60); з — саламандра (2n=34); и — овца (2n=54) |
Число хромосом у различных объектов также значительно колеблется, но характерно для каждого вида животных и растений. У некоторых радиолярий число хромосом достигает 1000-1600. Рекордсменом среди растений по числу хромосом (около 500) является папоротник ужовник, 308 хромосом у тутового дерева, у речного рака 196 хромосом. Наименьшее количество хромосом (2 хромосомы на гаплоидный набор) наблюдается у одной из рас аскариды, у сложноцветного Haplopappus gracilis всего 4 хромосомы (2 пары).
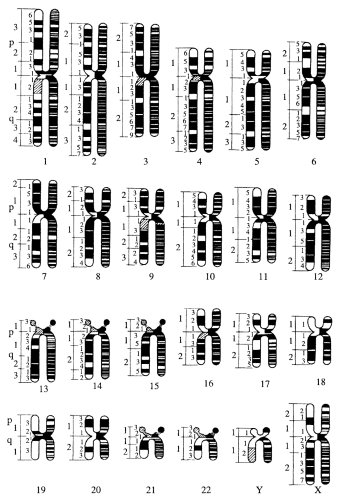
Совокупность числа, величины и морфологии хромосом называется кариотипом данного вида. Кариотип — это как бы лицо вида. Даже у близких видов хромосомные наборы отличаются друг от друга или по числу хромосом, или по величине хотя бы одной или нескольких хромосом, или по форме хромосом и по их структуре. Структура кариотипа данного вида не зависит ни от типа клеток, ни от возраста животного или растения. Все клетки индивидуумов одного вида имеют идентичные наборы хромосом. Простой морфологический анализ может убедительно показать различия в кариотипах даже у близких видов. Следовательно, структура кариотипа может быть таксономическим (систематическим) признаком, который все чаще используется в систематике животных и растений (рис. 34).
|
Рис. 34. Хромосомные наборы аксолотля (а) и вики (6) |
В последние годы в практику хромосомного анализа стали широко входить методы дифференциального окрашивания хромосом. Впервые метод был предложен Касперссоном, который показал, что при обработке препаратов митотических хромосом с помощью флуорохрома акрихиниприта во флуоресцентном микроскопе видна исчерченность по длине хромосом. В хромосомах были видны поперечные светящиеся полосы («бэнды») (Q-полосы, Q-окраска), расположение которых было характерно для каждой хромосомы.
Затем оказалось, что исчерченность тела хромосомы, ее способность дифференциально окрашиваться по длине, можно выявить с помощью нефлуоресцирующих красителей (например, смесь по Гимза: метилен-азур, метиленовый фиолетовый, метиленовый синий и эозин). Перед окраской препараты обрабатывают разными способами (короткая обработка трипсином, щелочными или кислыми растворами и др.). В зависимости от метода окраски можно выявить окрашивание прицентромерных участков (С-полосы, или перевязки) или различных полос в плечах и теломерах хромосом ( G -полосы). При этом, так же как при окраске акрихинипритом, расположение полос характерно для каждой хромосомы (рис. 35).
|
Рис. 35. Хромосомы даурского хомячка а — гистограмма размеров хромосом; б — дифференциальная окраска этих же хромосом |
Интересно, что получение дифференциальной окраски хромосом связано, скорее всего, с различной способностью к искусственной деконденсации разных участков хромосом. Так, дифференциальную окраску, соответствующую С- и G -полосам, можно получить при окраске обычным гематоксилином или наблюдать под фазовым контрастом на нефиксированных хромосомах в процессе их постепенной деконденсации при удалении двухвалентных катионов из окружающих хромосомы растворов, т.е. наблюдать дифференциальную деконденсацию митотических хромосом.
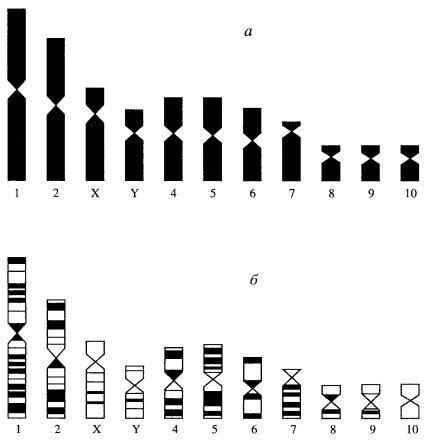
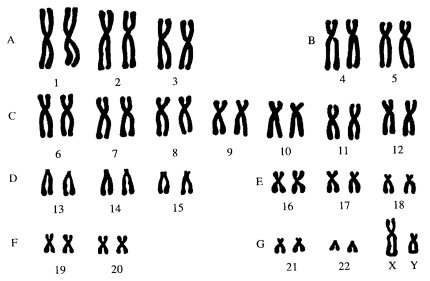
Такая дифференциальная окраска позволила детально изучить строение хромосом человека. При обычных методах окраски весь набор из 46 хромосом человека принято подразделять по их размерам на семь групп (А, В, С, D , E , F , G ). Если при этом легко отличить крупные (1-я, 2-я) хромосомы от мелких (19-я, 20-я), метацентрические от акроцентрических (13-я), то внутри групп трудно различить одну хромосому от другой. Так, в группе С 6-я и 7-я хромосомы схожи между собой также, как и с Х-хромосомой (рис. 36). Дифференциальное окрашивание позволяет четко отличить эти хромосомы друг от друга (рис. 37). Этот прием цитологического анализа в сочетании с генетическими наблюдениями уже в настоящее время позволил начать составлять хромосомные карты человека, т.е. находить места расположения генов на определенных участках хромосом (рис. 38).
|
Рис. 36. Кариотип мужчины Хромосомы обозначены согласно денверовской системе |
|
Рис. 37. Хромосомы мужчины при дифференциальной окраске |
|
Рис. 38. Генетическая карта хромосомы 1 человека Отдельные гены локализованы и определенных сегментах хромосомы: 1 — гены группы крови Сцианна, группы крови Do, ген фосфопируватгидратазы; 2 — гены фосфоглюконат-дегидрогеназы, эритроцитарной группы кропи резус (Rh), аденилаткиназы локус 2; 3 — ген фосфоглюкомутазы локус 1; 4 — гены уридин-монофосфаткиназы, эллиптоцитоза I, α-амилазы слюны, α-амилазы панкреатической, группы кропи Даффи и др.; 5 — глюкозо-1-фосфатуридилтрансферазы, катаракты; 6 — ген пептидазы С; 7 — гены 5S РНК; 8 — ген фумаратгидратазы; 9 — гены гуанилаткиназы, α-фукозидазы, место для аденовируса 12 |
Несмотря на то что молекулярные механизмы специфической окраски до сих пор еще не ясны, многие исследователи такую способность отдельных участков хромосом к окрашиванию связывают с их химическими различиями. Большое число наблюдений говорит о том, что избирательное окрашивание связано с локализацией так называемого гетерохроматина, ДНК которого обогащена А- и Т-основаниями.

Клеточный цикл эукариот
В отличие от клеточного цикла прокариот эукариотические клетки удваивают число своих хромосом в результате синтеза ДНК задолго до цитотомии, до разделения исходной клетки на две дочерние. Время протекания клеточного цикла у эукариот также значительно больше, чем у бактерий. Так, если для бактериальных клеток время от деления до деления клетки составляет 20—30 мин, то у одноклеточных эукариот, таких как инфузория туфелька, клеточный цикл занимает уже 10—20 ч, время клеточного цикла у амебы составляет около 1,5 суток. Около суток продолжается клеточный цикл и у многоклеточных организмов.
Клетки многоклеточных организмов обладают разной способностью к делению. Если в раннем эмбриогенезе клетки животных организмов делятся часто, то у взрослых особей они большей частью теряют эту способность. У круглых червей и коловраток клетки теряют способность к делению после прохождения эмбрионального развития, и рост организма, например аскариды, происходит не за счет роста числа клеток, а за счет увеличения их размера.
Клетки различных тканей и органов высших позвоночных имеют неодинаковую способность к делению. Встречаются клетки, полностью потерявшие свойство делиться: это большей частью специализированные, дифференцированные клетки (например, клетки центральной нервной системы, кардиомиоциты, клетки хрусталика глаза). В организме есть постоянно обновляющиеся ткани (различные эпителии, кровь, рыхлая и плотная соединительные ткани). В таких тканях существует часть клеток, которые постоянно делятся (например, клетки базального слоя покровного эпителия, клетки крипт кишечника, кроветворные клетки костного мозга и селезенки), заменяя отработавшие или погибающие клетки. Многие клетки, не размножающиеся в обычных условиях, приобретают вновь это свойство при процессах репаративной регенерации органов и тканей.
Примерно такие же типы клеток по их способности вступать в процесс деления встречаются и у растительных организмов: это интенсивно делящиеся камбиальные клетки, дающие начало различным органам и тканям; это клетки, возобновляющие деление при регенерации; это дифференцированные клетки, потерявшие способность делиться в естественных условиях.
Клетки многоклеточных животных и растений, также как одноклеточные эукариотические организмы, вступают в процесс деления после ряда подготовительных процессов, важнейшим из которых является синтез ДНК.
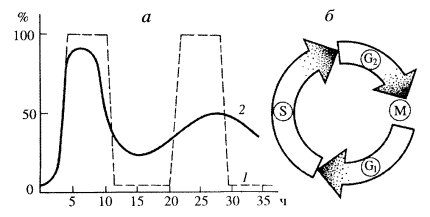
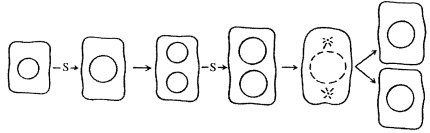
Весь смысл клеточного деления заключается в равномерном распределении редуплицированного генетического материала по двум новым клеткам. Следовательно, нужно ожидать, что от отделения до деления где-то в течение жизни клетки должен существовать период синтеза ДНК. Это предположение было подтверждено в радиоавтографических экспериментах. Если размножающимся клеткам животных или растений дать на короткое время меченый предшественник ДНК, а затем его убрать (так называемое импульсное мечение), то он будет включаться только в те клетки, в которых во время эксперимента шел синтез ДНК. В гетерогенной популяции клеток, среди которых были как делящиеся, так и неделящиеся клетки, метка включалась только в часть интерфазных клеток. Это наблюдение показывало, что синтез ДНК происходит только в интерфазе, в которой существуют периоды, когда синтез ДНК не происходит; отсутствие метки в некоторых интерфазных клетках могло говорить, что в них синтез ДНК или еще не начинался, или уже закончился.
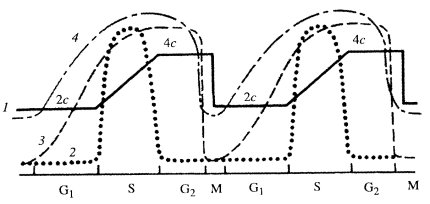
Это положение было доказано следующим образом. Если клеткам дать импульсную метку (например, меченный тритием предшественник ДНК - тимидин), а затем наблюдать за распределением метки среди клеток, взятых через определенные интервалы времени, то можно обнаружить следующую картину. Через некоторое время в образцах будут встречаться как меченые интерфазные клетки, так и немеченые клетки и делящиеся клетки, не содержащие метку. Клетки делящиеся, но не содержащие метки, — это те клетки, которые уже закончили синтез ДНК до начала эксперимента. Позднее в препаратах начинают появляться меченые делящиеся клетки. Это как раз те клетки, которые в момент введения меченого предшественника в интерфазе синтезировали ДНК, были в синтетическом периоде (S-период). Через некоторое время снова появляются немеченые делящиеся клетки - те, которые в момент введения меченого предшественника в интерфазе еще не вступили в S-период. Наконец, снова появляются меченые делящиеся клетки — это те, которые вступили в деление уже второй раз. Если построить график встречаемости меченых митозов (рис. 39), то получится многовершинная кривая: точки между соседними вершинами будут отражать полную длительность времени от деления до деления клетки - длительность клеточного цикла. Время от начала эксперимента до появления первых меченых митозов - это время интерфазы после S-периода, постсинтетический период, или, как принято его обозначать, G2-период.
|
Рис. 39. Изменение количества меченых митозов в разное время после однократного введения 3Н-тимидина а: 1 — идеальная кривая, 2 — кривая, полученная при изучении цикла клеток крипт тощей кишки мыши. По оси абсцисс — время, по оси ординат — процент меченых митозов; б — диаграмма в виде круга, обозначающего клеточный цикл и его отдельные фазы |
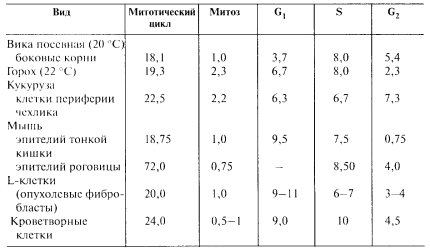
Оказалось, что S-периоду предшествует пресинтетический период, или G1-период, - отрезок времени от митоза до начала синтеза ДНК. Зная длительность клеточного синтеза, по проценту меченых клеток при импульсном введении меченого предшественника можно рассчитать длительность S-периода. Например, при времени клеточного цикла Т, равном 20 ч, встречается до 30% клеток, меченных 3Н-тимидином, из чего следует, что длительность S-периода занимает около 7 ч. Таким образом, весь клеточный цикл состоит как бы из четырех отрезков времени: собственно митоза (М), пресинтетического (G1), синтетического (S) и постсинтетического (G2) периодов: Т = G1 + S + G2 + M. Общая продолжительность как всего клеточного цикла, так и отдельных его отрезков (периодов) значительно варьирует не только у разных организмов, но и у клеток разных органов одного организма (табл. 2). Существуют объекты с более коротким клеточным циклом. Так, у некоторых дрожжей он занимает 1,5 ч, а при дроблении эмбриональных клеток амфибий — 0,5 ч.
Таблица 2 |
Длительность митотического цикла и его периодов (в часах) |
|
Различные периоды клеточного цикла отличаются друг от друга по общему содержанию в клетках белка, ДНК и РНК и по уровню (интенсивности) их синтеза. В G1-периоде клетки имеют диплоидное содержание ДНК на ядро (2с), в S-периоде содержание ДНК колеблется от 2с до 4с, в G2-периоде содержание ДНК соответствует тетраплоидному (4с). Следовательно, если мы изучаем однородную популяцию клеток, то простой фотометрией ДНК в интерфазных клетках можно определить, в каком из периодов клеточного цикла находится та или иная клетка (рис. 40).
|
Рис. 40. Диаграмма уровней клеточных синтезов в течение клеточного цикла 1 — содержание ДНК; 2 — интенсивность синтеза ДНК; 3 — интенсивность синтеза РНК; 4 — интенсивность синтеза белка. Остальные обозначения см. в тексте |
Количество РНК в клетках на разных этапах цикла также может меняться; в интенсивно делящихся клетках содержание РНК в течение интерфазы увеличивается по крайней мере в 2 раза. После деления в период G1 поступают дочерние клетки, в которых объем и общее со держание белков и РНК вдвое меньше, чем в исходной родительской клетке. В это время начинается рост клеток главным образом за счет накопления клеточных белков, что определяется увеличением количества РНК на клетку. Необходимо вспомнить, что в течение всего митоза (от поздней профазы до средней телофазы) синтез РНК в клетке полностью подавлен, поэтому накопление клеточных белков и РНК связано с возобновлением синтеза РНК в начале нового клеточного цикла. В S-периоде уровень синтеза РНК возрастает соответственно увеличению количества ДНК и достигает своего максимума в середине G2-периода. В конце G2-периода или в профазе синтез РНК резко падает по мере конденсации митотических хромосом и снова полностью прекращается во время митоза.
Синтез белка во время митоза падает до 25% от исходного уровня и затем в последующих периодах достигает своего максимума в G2-периоде, в общем повторяя характер синтеза РНК.
Отдельные периоды интерфазы отличаются друг от друга не только общим содержанием и активностью синтезов ДНК, РНК и белка, но и характером синтезируемых РНК и белков.
Такое регулярное повторение последовательности клеточных циклов легко можно наблюдать во время прогрессивного роста клеток культуры ткани. В естественных условиях в растущих тканях растений и животных всегда есть клетки, которые находятся «вне цикла», не переходят регулярно из G1- в S-, затем в G2- и потом в М-фазу; такие клетки принято называть клетками G0-периода. Именно эти клетки представляют собой так называемые покоящиеся, переставшие размножаться клетки. Под действием специфических белковых ростовых факторов, или митогенов, они могут снова вступать в клеточный цикл и начать делиться. В некоторых тканях такие клетки G0-фазы могут находиться длительное время, не изменяя особенно своих морфологических свойств: они сохраняют в принципе способность к делению, превращаясь и камбиальные, стволовые клетки (например, в кроветворной ткани). Чаще такая потеря (хотя бы и временная) способности делиться сопровождается специализацией, дифференцировкой клеток. В этом случае дифференцирующиеся клетки выходят из цикла, но в особых условиях могут снова входить в цикл. Например, большинство клеток печени находится в G0-периоде; они не участвуют в синтезе ДНК и не делятся. Однако если произвести удаление части печени, то многие клетки начинают подготовку к митозу (G1-период), переходят к синтезу ДНК и могут митотически делиться. В других органах, выходя из клеточного цикла, клетки необратимо дифференцируются и теряют способность к делению навсегда. Так происходит с нейронами: нейробласты (эмбриональные нервные клетки) после нескольких циклов клеточного деления теряют способность размножаться, дифференцируются и остаются в этом состоянии до конца жизни организма.
Следует отметить особо, что у многоклеточных зрелых организмов заведомо большая часть клеток находится в G0-фазе. Прохождение клетками клеточного цикла как в интенсивно размножающихся популяциях, так и в клетках, стимулированных к размножению, регулируется целой сложной системой циклирующих белков, от активности которых зависит прохождение каждой из стадий клеточного цикла.

Эндорепродукция и полиплоидия
Если делящиеся клетки на некоторое время охладить или обработать каким-либо веществом, разрушающим микротрубочки веретена (например, колхицином), то деление клеток прекратится. При этом исчезнет веретено, а хромосомы без расхождения к полюсам будут продолжать цикл своих превращений: они начнут набухать, одеваться ядерной оболочкой. Так возникают за счет объединения всех неразошедшихся наборов хромосом крупные новые ядра. Они, естественно, будут содержать вначале 4n число хроматид и соответственно 4с количество ДНК. По определению, это уже не диплоидная, а тетраплоидная клетка. Такие полиплоидные клетки могут из стадии G1 переходить в S-период и, если убрать колхицин, снова делиться митотическим путем, давая уже потомков с 4n числом хромосом. В результате можно получить полиплоидные клеточные линии разной величины плоидности (4n , 8n, 16n и т.д.). Этот прием часто используется для получения полиплоидных растений.
Как оказалось, во многих органах и тканях нормальных диплоидных организмов животных и растений встречаются клетки с крупными ядрами, количество ДНК в которых кратно больше 2n. При делении таких клеток видно, что количество хромосом у них также кратно увеличено по сравнению с обычными диплоидными клетками. Эти клетки являются результатом соматической полиплоидии. Часто это явление называют эндорепродукцией - появление клеток с увеличенным содержанием ДНК. Подобные клетки появляются в результате отсутствия в целом или в результате незавершенности отдельных этапов митоза. Существует несколько точек в процессе митоза, блокада которых приведет к его остановке и к появлению полиплоидных клеток. Блокада может наступить при переходе от G2-периода к собственно митозу, остановка может произойти в профазе и метафазе, в последнем случае часто происходит нарушение целостности веретена деления. Наконец, нарушения цитотомии также могут прекратить деление, что приведет к появлению двуядерных и полиплоидных клеток.
При естественной блокаде митоза в самом его начале - при переходе G2 в профазу - клетки приступают к следующему циклу репликации, который приведет к прогрессивному увеличению количества ДНК в ядре. При этом не наблюдается никаких морфологических особенностей таких ядер, кроме их больших размеров. При увеличении ядер в них не выявляются хромосомы митотического типа. Часто такой тип эндорепродукции без митотической конденсации хромосом встречается у беспозвоночных животных, обнаруживается он также и у позвоночных животных, и у растений.
У беспозвоночных в результате блока митоза степень полиплоидии может достигать огромных значений. Так, в гигантских нейронах моллюска тритонии, ядра которых достигают величины до 1 мм (!), содержится более 2·105 гаплоидных наборов ДНК. У некоторых беспозвоночных гигантские железистые и нервные клетки в результате 18—20 циклов эндоредупликации могут содержать 2097152с ДНК.
Другим примером гигантской полиплоидной клетки, образовавшейся в результате редупликации ДНК без вступления клеток в митоз, может служить клетка шелкоотделительной железы тутового шелкопряда. Ее ядро имеет причудливую ветвистую форму и может содержать огромные количества ДНК. Гигантские клетки железы пищевода аскариды могут содержать до 100000с ДНК.
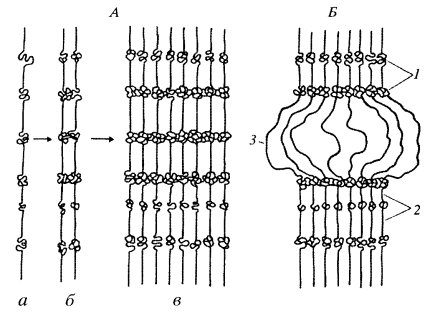
Особый случай эндорепродукции представляет собой увеличение плоидности путем политении. При политении в S-периоде при репликации ДНК новые дочерние хромосомы продолжают оставаться в деспирализованном состоянии, но располагаются друг около друга, не расходятся и не претерпевают митотической конденсации (рис. 41). В таком истинно интерфазном виде хромосомы снова вступают в следующий цикл репликации, снова удваиваются и не расходятся. Постепенно в результате репликации и нерасхождения хромосомных нитей образуется многонитчатая, политенная структура хромосомы интерфазного ядра. Последнее обстоятельство необходимо подчеркнуть, так как такие гигантские политенные хромосомы никогда не участвуют в митозе, более того - это истинно интерфазные хромосомы, участвующие в синтезе ДНК и РНК.
|
Рис. 41. Схема строения политенной хромосомы (А) и ее участков (Б) а — нить интерфазной хромосомы с участками конденсированного хроматина; б — две нити после редупликации; в — восемь сближенных нитей в результате трехкратной редупликации хромосом; 1 — диски; 2 — междисковые участки; 3 — пуф, образовавшийся за счет деконденсации хроматина диска |
От митотических хромосом они резко отличаются и по размерам: они в несколько раз толще митотических хромосом из-за того, что состоят из пучка множественных неразошедшихся хроматид; по объему политенные хромосомы дрозофилы в 1000 раз больше митотических. Они в 70—250 раз длиннее митотических вследствие того, что в интерфазном состоянии хромосомы менее конденсированы (спирализованы), чем митотические хромосомы (рис. 42). Кроме того, у двукрылых их общее число в клетках равно гаплоидному из-за того, что при политенизации происходит объединение — конъюгация — гомологичных хромосом. Например, диплоидная соматическая клетка дрозофилы содержит восемь хромосом, а гигантская клетка слюнной железы — четыре.
|
Рис. 42. Набор политенных хромосом из гигантских клеток слюнных желез дрозофилы (а) в сравнении с размером митотических хромосом в делящихся клетках (б) |
Встречаются гигантские полиплоидные ядра с политенными хромосомами у некоторых личинок двукрылых насекомых в клетках слюнных желез, кишечника, мальпигиевых сосудов, жирового тела и т.д. Политенные хромосомы встречаются также в ядрах синергид некоторых луков, в ядрах антипод аконита и пшеницы. Описаны политенные хромосомы в макронуклеусе инфузории стилонихии.
Лучше всего этот тип эндорепродукции изучен у насекомых. Подсчитано, что у дрозофилы в клетках слюнных желез может произойти до 6-8 циклов редупликации, что приведет к общей плоидности клетки, равной 1024. У некоторых хирономид (их личинку называют мотылем) плоидность в этих клетках достигает 8000-32000. В клетках политенные хромосомы становятся видны после достижения политении в 64-128n, до этого такие ядра ничем, кроме размера, не отличаются от окружающих диплоидных ядер.
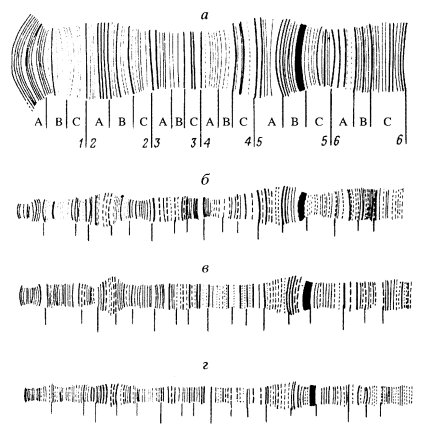
Отличаются политенные хромосомы и своим строением: они структурно неоднородны по длине, состоят из дисков, междисковых участков и пуфов (рис. 43). Рисунок расположения дисков строго характерен для каждой хромосомы и отличается даже у близких видов животных.
|
Рис. 43. Один и тот же участок политенной хромосомы Chironomus tentans в ядрах слюнной железы (а), мальпигиева сосуда (б), прямой (в) и средней (г) кишки |
Диски представляют собой участки конденсированного хроматина. Если на одной интерфазной хромосоме участки конденсированного хроматина будут выглядеть как глобулярные сгустки (хромомеры), то при латеральном расположении множества одинаковых интерфазных хромосом эти отдельные участки выстроятся в диск, лежащий поперек хромосомы. Хромомерное строение дисков политенных хромосом отчетливо проявляется при искусственной деконденсации этих хромосом растворами с низким содержанием двухвалентных катионов. При этом диски (особенно мелкие) распадаются на ряд хромомеров (0,2-0,3 мкм), от которых радиально отходят фибриллы ДНП, подобно тому, что наблюдается при такой же деконденсации митотических хромосом и хроматина интерфазных ядер.
Диски могут отличаться друг от друга по толщине. Общее их число у политенных хромосом хирономид достигает 1,5-2,5 тыс. У дрозофилы имеется около 5 тыс. дисков. Диски разделены междисковыми пространствами, состоящими, так же как и диски, из фибрилл хроматина, только более рыхло упакованных (см. рис. 30, б).
На политенных хромосомах двукрылых часто видны вздутия - пуфы. Оказалось, что пуфы возникают на местах некоторых дисков за счет их деконденсации и разрыхления. В пуфах выявляется РНК, которая там же и синтезируется. Следовательно, пуф является местом транскрипции на этих интерфазных хромосомах и представляет собой экспрессированные хромосомные участки.
Рисунок расположения и чередования дисков на политенных хромосомах постоянен и не зависит ни от органа, ни от возраста животного. Это является хорошей иллюстрацией одинаковости качества генетической информации в каждой клетке организма (см. рис. 43).
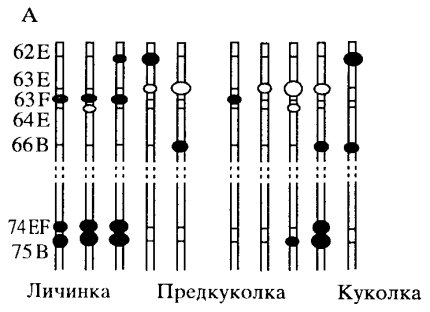
Однако в расположении пуфов такой однозначности нет. Пуфы являются временными образованиями на хромосомах, и в процессе развития организма существует определенная последовательность в их появлении и исчезновении на генетически различных участках хромосомы (рис. 44). Эта последовательность различна для разных тканей. Сейчас доказано, что образование пуфов на политенных хромосомах - это выражение генной активности: в пуфах синтезируются РНК, необходимые для проведения белковых синтезов на разных этапах развития насекомого. Оказалось, что можно вызывать специфическую индукцию активности пуфов. Так, на определенной стадии развития личинки гормон экдизон вызывает активацию специфических пуфов, что предшествует линьке. Если же этот гормон ввести на другой стадии развития, то в этом случае активируется тот же пуф, хотя в норме он на этой стадии не функционирует.
|
Рис. 44. Последовательность образования пуфов на различных локусах хромосом слюнной железы дрозофилы (плечо хромосомы 3) (Ashburn, 1967) |
В естественных условиях у двукрылых особенно активны в отношении синтеза РНК два самых крупных пуфа, так называемые кольца Бальбиани, который описал их 100 лет тому назад. Совсем недавно с помощью микроманипулятора удалось выделить кольца в достаточном количестве, чтобы определить тип их РНК. Это оказалась информационная РНК с гигантской молекулярной массой (70 тыс. нуклеотидов), кодирующая образование секреторных белков слюнных желез. Эта же РНК была выделена из полисом цитоплазмы. Размер гранул РНП, которые образуются в кольцах (пуфах) Бальбиани, достигает 40-60 нм.
Долгое время неясной оставалась природа междисковых участков в политенных хромосомах. Была выдвинута гипотеза, что в междисковых участках могут также располагаться гены, которые находятся в деконденсированном состоянии, в отличие от генов в дисках, где они неактивны. Это предположение в последнее время получило ряд подтверждений. Так, в междисковых участках были обнаружены гранулы и фибриллы РНП такой же морфологии, как и в мелких пуфах. В междисковых участках зарегистрировано слабое включение в РНК, там с помощью иммунохимических методов удалось локализовать РНК-полимеразу и ДНК—РНК-комплексы, что указывает на участие междисковых зон в синтезе РНК. Характер этой РНК неясен. Возможно, что это РНК генов, работа которых в клетке необходима постоянно, генов, которые кодируют белки основного метаболизма клетки, т.е. белки «для домашнего хозяйства». Информация же, необходимая для специализации, дифференцировки, в таком случае должна поступать от пуфов.
Так как расположение дисков на хромосомах зависит только от видовой специфики, то удалось с помощью генетических методов локализовать целый ряд генов и нанести их на морфологические карты хромосом. Отдельный диск может быть вместилищем одного или нескольких генов. Целый ряд признаков удалось локализовать в определенных участках хромосом.
Как уже указывалось, гигантские хромосомы встречаются в некоторых клетках зародышевых тканей растений. Такие гигантские хромосомы были описаны, например, у фасоли и ячменя. Это толстые короткие хромосомы, во много десятков раз превосходящие по объему митотические хромосомы. В антиподиальных клетках ячменя в огромных ядрах видны семь (гаплоидное число) хромосом, которые претерпели до 20 циклов репликации. Однако общая их организация резко отлична от таковой у двукрылых насекомых. Во-первых, в данном случае нет разделения тела хромосомы на диски и междисковые участки, во-вторых, нет пуфов. Все РНП-продукты равномерно расположены вдоль хроматиновых участков. Хроматин этих гигантских хромосом обладает типичной хромонемной организацией, характерной для интерфазных ядер этого объекта (рис. 45).
|
Рис. 45. Политенные хромосомы в ядре антипод Dicentra spectabilis |
Итак, мы разобрали два случая, два способа образования полиплоидных клеток, возникающих при блокаде вступления их в митотическое деление.
В других случаях эндорепродукции полиплоидные клетки возникают в результате нарушений аппарата деления — веретена: при этом происходит митотическая конденсация хромосом. Такое явление носит название эндомитоз, потому что конденсация хромосом и их изменения происходят внутри ядра, без исчезновения ядерной оболочки (рис. 46).
|
Рис. 46. Схема эндомитоза в клетках тапетума шпината 1 — эндопрофаза; 2 — эндометафаза; 3 — эндоанафаза; 4 — эндотелофаза |
Впервые явление эндомитоза было хорошо изучено в клетках различных тканей водяного клопа — геррии. В начале эндомитоза хромосомы конденсируются, благодаря чему становятся хорошо различимы внутри ядра, затем хроматиды обособляются, вытягиваются. Эти стадии по состоянию хромосом могут соответствовать профазе и метафазе обычного митоза. Затем хромосомы в таких ядрах исчезают, и ядро принимает вид обычного интерфазного ядра, но размер его увеличивается в соответствии с увеличением плоидности. После очередной редупликации ДНК такой цикл эндомитоза повторяется. В результате могут возникнуть полиплоидные (32n) и даже гигантские ядра.
Сходный тип эндомитоза описан при развитии макронуклеусов у некоторых инфузорий, у целого ряда растений. Так, в клетках клубней картофеля хромосомы практически все время находятся в спирализованном состоянии, время собственно интерфазы здесь значительно укорочено.
Следующий вариант появления полиплоидных клеток связан с отсутствием веретена на стадии метафазы: при этом происходит слияние двух хромосомных наборов, как в случае применения колхицина.
Иной процесс появления полиплоидных соматических клеток в результате блокады деления клеточного тела подробно изучен на клетках млекопитающих. Было обнаружено, что в печени взрослых, и особенно стареющих, крыс и мышей встречаются кроме диплоидных тетра- и октоплоидные клетки, а также двуядерные клетки разной степени плоидности. Оказалось, что в этом случае процесс полиплоидизации клеток можно описать следующим образом (рис. 47). После S-периода клетки, обладающие 4с количеством ДНК, вступают в митотическое деление, проходят все его стадии, включая телофазу, но не приступают к цитотомии. Таким образом, образуется двуядерная клетка (2·2n). Она может снова пройти S-период, в результате чего оба ядра в такой клетке станут содержать по 4с ДНК и 4n хромосом. Такая двуядерная клетка входит в митоз, на стадии метафазы происходит объединение хромосомных наборов (общее число хромосом равно 8n), а затем нормальное деление, в результате которого образуются две тетраплоидные клетки. Процесс попеременного появления двуядерных и одноядерных клеток может привести к появлению ядер с 8n, 16n и даже 32n количеством хромосом. Таким способом образуются полиплоидные клетки в печени, в эпителии мочевого пузыря, в пигментном эпителии сетчатки, в ацинарных отделах слюнной и поджелудочной желез, на ранних стадиях образования мегакариоцитов и др.
|
| Рис. 47. Образование двуядерных и полиплоидных клеток паренхимы печени S — синтез ДНК |
В целом ряде случаев процессы эндорепродукции используются организмом как для построения тканей, так и для их функционирования. В чем же биологический смысл этого явления? Необходимо отметить, что соматическая полиплоидизация встречается на терминальных участках пути развития клеток, тканей и организмов, она большей частью характерна для специализированных, дифференцированных клеток и не встречается при генеративных процессах, таких, как эмбриогенез (исключая провизорные органы) и образование половых клеток, нет полиплоидии среди стволовых клеток. Действительно, гигантские полиплоидные клетки в деление не вступают; клетки с политенными хромосомами также не делятся и в процессе метаморфоза насекомых лизируются. Многоядерные и полиплоидные клетки у млекопитающих встречаются главным образом у стареющих организмов.
По-видимому, главным результатом соматической полиплоидии является увеличение размера клеток и тем самым увеличение их продуктивности.

Пространственное расположение хромосом в интерфазном ядре
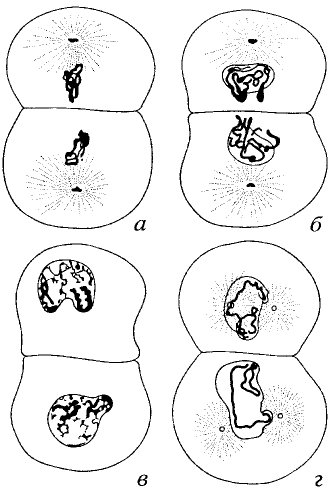
Представление о том, что митотические хромосомы после деления клеток превращаются в хроматин интерфазного ядра, не теряют своей целостности (не распадаются на фрагменты), а сохраняют свою физическую индивидуальность, переходя лишь в разрыхленное, деконденсированное состояние, было высказано Т. Бовери еще в 1887 г. Эти представления получили название теории непрерывности хромосом, которая гласит: хромосомы, вошедшие в состав дочернего ядра в телофазе, сохраняются в нем хотя бы и в очень измененном виде в качестве индивидуальных структур и появляются снова в собственном смысле слова в следующей профазе.
Основой для этого вывода послужило наблюдение Т. Бовери за поведением хромосом в дробящихся яйцах одного из видов аскариды (Ascaris megalocephala univaiens), в клетке которой всего две хромосомы. Было обнаружено, что в профазе первых двух делений зиготы хромосомы вновь обнаруживаются в местах бывших телофазных хромосом предыдущего деления, повторяя их форму и локализацию (рис. 48). Конечно, эти наблюдения не могут служить прямым доказательством этой теории, но являются основой для высказывания предположения о судьбе хромосом в клеточном цикле. Однако кроме этого наблюдения существует целая серия косвенных данных, говорящих в пользу теории непрерывности хромосом. Вот некоторые из них.
|
| Рис. 48. Морфологическое постоянство хромосом в первых делениях дробления аскариды (Бовери, 1909) а — первое деление, поздняя анафаза; б — первое деление, ранняя телофаза; в — интерфаза; г — профаза второго деления. Обратите внимание на сходство в расположении хромосом в б, в и г |
В интерфазных ядрах целого ряда объектов удается регистрировать отдельные специфические участки, аналогичные по своим свойствам теломерам и центромерам митотических хромосом. Например, у некоторых луков все хромосомы имеют постоянно конденсированные участки на теломерах (рис. 49). Эти теломеры митотических хромосом обладают свойством окрашиваться как С-сегмент. В интерфазных ядрах этих видов также обнаруживаются С-положительные зоны. Их количество вдвое меньше, чем число плечей митотических хромосом, вероятно, за счет того, что в интерфазе теломерные участки соседних хромосом могут ассоциировать друг с другом. Интересно, что в интерфазном ядре такие участки располагаются на одном из полюсов, как бы повторяя теломерную ориентацию хромосом в митозе.
|
| Рис. 49. Полярное периферическое расположение теломерных хромоцентров (показано стрелками) в телофазных ядрах клеток меристемы корешка A. fistulosum |
Подобным же образом можно наблюдать в интерфазных ядрах центромерные участки хромосом. Так, у мыши центромеры всех акроцентрических хромосом интенсивно окрашиваются по методике выявления С-сегментов (рис. 50). Таким же свойством обладают связанные с периферией ядра плотные участки интерфазного хроматина — хромоцентры. Показано, что эти участки по своей молекулярной композиции аналогичны центромерным участкам митотических хромосом.
|
| Рис. 50. С-окраска центромерных районов метафазных хромосом (а) и интерфазного ядра (б) клеток культуры мыши |
Наконец, в интерфазных клетках можно наблюдать целые отдельные хромосомы; например, одну из Х-хромосом самок млекопитающих. Правда, по морфологии такие целиком конденсированные хромосомы (тельца Барра) отличаются от митотических хромосом, но по объему и количеству ДНК полностью соответствуют Х-хромосоме в митозе. У пашенной полевки (Microtus agrestis) X половые хромосомы обладают способностью целиком интенсивно окрашиваться по С-методике. В интерфазных ядрах различных клеток самок этого животного можно с помощью этой же окраски видеть два больших блока интенсивно окрашенного хроматина.
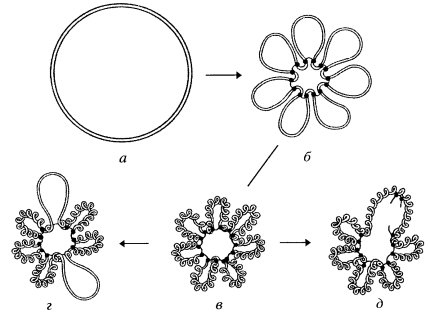
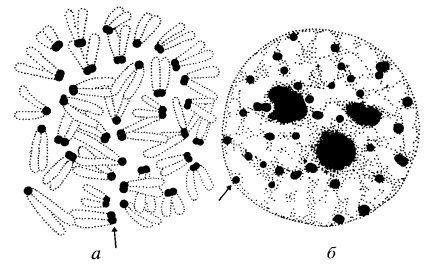
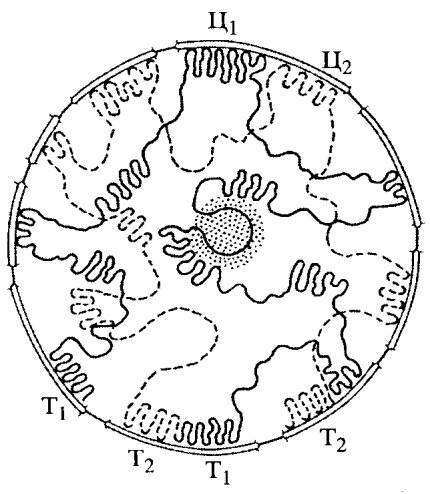
Каково же пространственное расположение отдельных деконденсированных интерфазных хромосом в трехмерном объеме клеточного ядра? Существует ли какой-либо порядок в размещении хромосом в интерфазном ядре или же они хаотически разбросаны внутри ядра? Первые исследования о порядке расположения хромосом внутри ядра принадлежат К. Раблю (1885), который, изучая профазные ядра растений, предположил, что внутри ядра хромосомы повторяют свою анафазную ориентацию (центромеры на одном полюсе, теломеры на другом) в течение всего клеточного цикла.
В пользу этого говорит расположение в интерфазном ядре центромерных и теломерных участков деконденсированных хромосом. Но особенно демонстративно это положение было показано при изучении пространственной локализации политенных хромосом. С помощью послойных оптических разрезов, используя компьютерную технику воспроизведения изображения, удалось создать объемную стереоскопическую реконструкцию интерфазного ядра и проследить в его трехмерном пространстве каждую из четырех гигантских политенных хромосом (рис. 51). Обнаружено, что действительно в объеме ядер хромосомы располагаются, повторяя ана-телофазную ориентацию (так называемую ориентацию по Раблю). При этом каждое плечо хромосомы занимает определенную зону, объем которой не заходит в объем соседних хромосом, хотя они расположены тесно друг с другом. Каждая из хромосом образует пологую правую спираль (5-7 витков), которая в нескольких местах связана с ядерной оболочкой, как бы фиксируясь на ней. Фиксированы на ядерной оболочке и теломерные участки всех хромосом, которые располагаются на одном из полюсов интерфазного ядра. На противоположном полюсе ядра также в связи с ядерной оболочкой располагаются центромерные районы хромосом, часто объединенные в один хромоцентр — крупный блок интерфазного хроматина.
|
| Рис. 51. Трехмерная реконструкция топографии политенных хромосом в ядре слюнной железы дрозофилы Т — теломеры хромосом; Ц — центромеры |
Прямые наблюдения за локализацией в ядре интерфазных хромосом были сделаны с помощью метода FISH (флуоресцентная in situ гибридизация нуклеиновых кислот) в сочетании с конфокальной микроскопией. Вначале выделили индивидуальные митотические хромосомы, из них получили ДНК, которые метились разными флуорохромами. Такие меченые хромосомные ДНК наносились на препараты интерфазных ядер, ДНК которых была предварительно денатурирована. В результате молекулярной гибридизации флуоресцирующая ДНК ренатурировала только со сходной хромосомой. С помощью конфокального микроскопа просматривалась флуоресцентная метка в трехмерном пространстве интерфазного ядра. Было обнаружено, что интерфазное ядро состоит из тесно расположенных хромосомных территорий, объем которых значительно превосходил объем митотических хромосом. Некоторые особенно крупные хромосомы действительно проявляли ана-телофазную ориентацию.
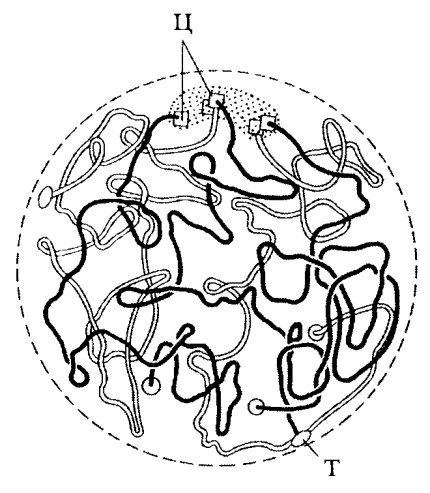
Суммируя общие представления о формах организации хромосом, можно прийти к заключению, что они могут находиться в двух альтернативных состояниях, в двух морфологических выражениях: 1) максимально конденсированное, компактное, метаболически неактивное, транспортное состояние, предназначенное для того, чтобы в минимальном объеме без структурных нарушений перенести во время клеточного деления огромные по длине молекулы ДНК; 2)деконденсированное, при котором линейная длина развернутых хромосом увеличивается в десятки, а иногда и в сотни раз, метаболически активное состояние, связанное с синтезом ДНК и РНК (интерфаза).
Отличительной особенностью интерфазной хромосомы от митотической, кроме всего прочего, является то, что по своей длине она может быть деконденсирована, развернута неравномерно: наряду с участками полной деконденсации есть участки, находящиеся в плотном, конденсированном и, соответственно, в неактивном состоянии. Это и придает интерфазному ядру своеобразную структуру, где хромосомы — хроматин — могут быть представлены то плотными блоками, то рыхлыми деконденсированными участками (рис. 52).
|
| Рис. 52. Схема пространственного расположения двух интерфазных хромосом. Участки хромосом: Т — теломерные, Ц — центромерные |

Величко В.В. © Copyright 2008.![]()
![]()