О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИ
ЯДЕРНЫЙ БЕЛКОВЫЙ МАТРИКС
ХРОМОНЕМНЫЙ (ЧЕТВЕРТЫЙ) УРОВЕНЬ УПАКОВКИ ХРОМАТИНА
НЕРИБОСОМНЫЕ ПРОДУКТЫ КЛЕТОЧНОГО ЯДРА

Общий состав ядерного матрикса
Мы уже познакомились с тем, что в интерфазном ядре развернутые хромосомы располагаются не хаотично, а строго упорядоченно. Такая организация хромосомы в трехмерном пространстве ядра необходима не только для того, чтобы при митозе происходила сегрегация хромосом и их обособление от соседей, но и для упорядочения процессов репликации и транскрипции хроматина. Вероятно, для осуществления этих задач должна существовать какая-то каркасная внутриядерная система, которая может служить объединяющей основой для всех ядерных компонентов: хроматина, ядрышка, ядерной оболочки. Такой структурой является белковый ядерный остов, или матрикс. Необходимо сразу же оговориться, что ядерный матрикс не представляет собой четкой морфологической структуры; он выявляется как отдельный морфологический гетерогенный компонент при экстракции из ядер практически всех участков хроматина, основной массы РНК и липопротеидов ядерной оболочки. От ядра, которое не теряет при этом сво ей общей морфологии, являясь сферической структурой, остается как бы каркас, остов, который иногда называют еще «ядерным скелетом».
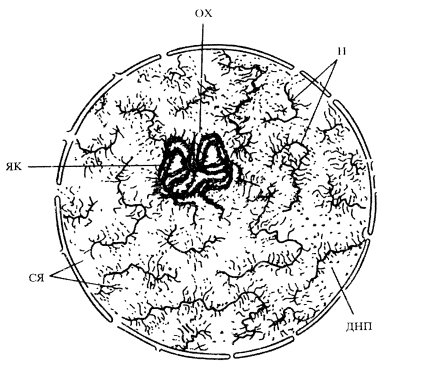
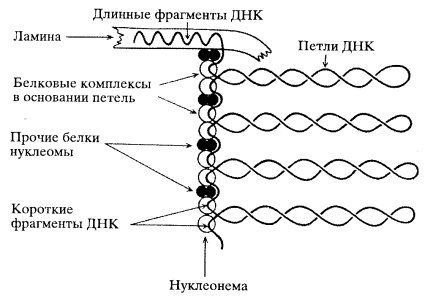
Впервые компоненты ядерного матрикса (остаточные ядерные белки) были выделены и охарактеризованы в начале 1960-х годов. Обнаружено, что при последовательной обработке изолированных ядер печени крыс 2М раствором NaCl, а затем ДНКазой происходит полное растворение хроматина, а основными структурными элементами ядра остаются: ядерная оболочка, связанные с ней компоненты - нуклеонемы (ядерные нити), содержащие белок и РНК, и ядрышки. Была высказана гипотеза, что фибриллы хроматина в нативных ядрах прикреплены к этим осевым белковым нитям наподобие ершика для чистки бутылок (рис. 67).
|
Рис. 67. Гипотетическая схема строения интерфазного ядра (Георгиев, Ченцов, 1960) Н — нуклеопема; ЯК — ядрышко; ОХ — околоядрышковый хроматин; СЯ — ядерный сок; ДНП — дезоксирибонуклеопротеид |
Значительно позднее (середина 1970-х годов) эти работы получили развитие и привели к появлению массы новых сведений о нехроматиновых белках ядерного остова и о его роли в физиологии клеточного ядра. В это же время был предложен термин «ядерный матрикс» дли обозначения остаточных структур ядра, которые могут быть получены в результате последовательных экстракций ядер различными растворами. Новым в этих приемах было использование неионных детергентов, таких как Тритон Х-100, растворяющих ядерные липопротеидные мембраны.
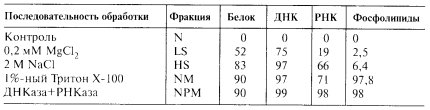
Последовательность обработки выделенных ядер, приводящая к получению препаратов ядерного матрикса, обогащенного белком, представлена в табл. 6.
Таблица 6 |
Экстракция (в %) ядерных компонентов в процессе получения ядерного белкового матрикса |
|
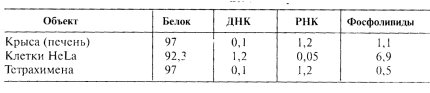
Изолированные ядра, полученные в растворах 0,25М сахарозы, 0,05М трис-HCl буфера и 5 мМ MgCl2 , помещались в раствор низкой ионной силы (LS), где деградировала основная масса ДНК за счет эндонуклеазного расщепления. В 2М NaCl (HS) затем происходила диссоциация хроматина на гистоны и ДНК, шла дальнейшая экстракция фрагментов ДНК и различных белков. Последующая обработка ядер в 1%-ном растворе Тритона Х-100 приводила к почти полной потере фосфолипидов ядерной оболочки и получению ядерного матрикса (NM), содержащего остатки ДНК и РНК, которые дополнительно растворялись при обработке нуклеазами, в результате чего получали конечную фракцию ядерного белкового матрикса (NPM). Он состоит на 98% из негистоновых белков, в него, кроме того, входит 0,1% ДНК, 1,2% РНК и 1,1% фосфолипидов. Химический состав ядерного матрикса, полученный таким способом, сходен у различных объектов (табл. 7).
Таблица 7 |
Состав ядерного белкового матрикса |
|
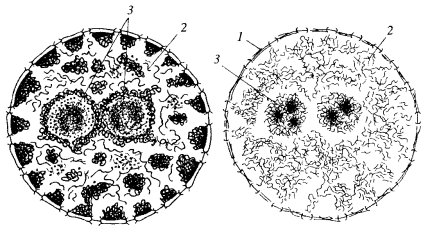
По своей морфологической композиции ядерный матрикс состоит, по крайней мере, из трех компонентов: периферического белкового сетчатого (фиброзного) слоя — ламины (nuclear lamina, fibrous lamina), внутренней, или интерхроматиновой, сети (остов) и «остаточного» ядрышка (рис. 68).
|
Рис. 68. Ядерный белковый матрикс а — схема строения ядер до экстракции; б — после экстракции; 1 — примембранный белковый слой (ламина) и поровые комплексы; 2 — межхроматиновая белковая сеть матрикса; 3 — белковый матрикс ядрышка |
Ламина представляет собой тонкий фиброзный слой, подстилающий внутреннюю мембрану ядерной оболочки. В ее состав входят также комплексы ядерных пор, которые как бы вмурованы в фиброзный слой. Часто эту часть ядерного матрикса называют фракцией «поровый комплекс—ламина» (PCL: pore complex—lamina). В интактных клетках и ядрах ламина большей частью морфологически не выявляется, так как к ней тесно прилегает слой периферического хроматина. Лишь иногда ее удается наблюдать в виде относительно тонкого (10—20 нм) фиброзного слоя, располагающегося между внутренней мембраной ядерной оболочки и периферическим слоем хроматина.
Структурная роль ламины очень велика: она образует сплошной фиброзный белковый слой по периферии ядра, достаточный для того, чтобы поддерживать морфологическую целостность ядра. Так, удаление обеих мембран ядерной оболочки с помощью Тритона Х-100 не вызывает распада, растворения ядер. Они сохраняют свою округлую форму и не расплываются даже в случае перевода их в низкую ионную силу, когда происходит набухание хроматина.
Внутриядерный остов, или сеть, морфологически выявляется только после экстракции хроматина. Он представлен рыхлой фиброзной сетью, располагающейся между участками хроматина, часто в состав этой губчатой сети входят различные гранулы РНП-природы.
Наконец, третий компонент ядерного матрикса - «остаточное» ядрышко — плотная структура, повторяющая по своей форме ядрышко, также состоит из плотно уложенных фибрилл.
Морфологическая выраженность этих трех компонентов ядерного матрикса, так же как и количество во фракциях, зависит от целого ряда условий обработки ядер. Лучше всего элементы матрикса выявляются после выделения ядер в относительно высоких (5 мМ) концентрациях двухвалентных катионов.
Для выявления белкового компонента ядерного матрикса большое значение имеет образование дисульфидных связей. Так, если ядра предварительно инкубировать с иодацетамидом, препятствующим образованию S-S-связей, а затем вести ступенчатую экстракцию, то ядерный матрикс представлен только комплексом PCL. Если же использовать тетратионат натрия, вызывающий замыкание S—S-связей, то ядерный матрикс представлен всеми тремя компонентами. В ядрах, предварительно обработанных гипотоническими растворами, выявляются только ламина и «остаточные» ядрышки.
Все эти наблюдения привели к выводу, что компоненты ядерного матрикса представляют собой не застывшие жесткие структуры, а компоненты, обладающие динамической подвижностью, которые могут меняться не только в зависимости от условий их выделения, но и от функциональных особенностей нативных ядер. Например, в зрелых эритроцитах кур весь геном репрессирован и хроматин локализован преимущественно на периферии ядра, в этом случае внутренний матрикс не выявляется, а можно видеть только ламину с порами. В эритроцитах пятидневных куриных эмбрионов, ядра которых сохраняют транскрипционную активность, элементы внутреннего матрикса выражены отчетливо.
Как было видно из табл. 7, основной компонент остаточных структур ядра - белок, содержание которого может колебаться от 98 до 88%. Белковый состав ядерного матрикса из разных клеток довольно близок. Характерными для него являются три белка фиброзного слоя, называемые ламинами. Кроме этих основных полипептидов в матриксе присутствует большое количество минорных компонентов с молекулярными массами от 11—13 до 200 кДа.
Ламины представлены тремя белками (ламины А, В, С). Два из них, ламины А и С, близки друг к другу иммунологически и по пептидному составу. Ламин В от них отличается тем, что он представляет собой липопротеид и поэтому более прочно связывается с ядерной мембраной. Ламин В остается в связи с мембранами даже во время митоза, тогда как ламины А и С освобождаются при разрушении фиброзного слоя и диффузно распределяются по клетке.
Как оказалось, ламины близки по своему аминокислотному составу промежуточным микрофиламентам (виментиновым и цитокератиновым), входящим в состав цитоскелета. Часто фракция выделенных ядер, а также препараты ядерного матрикса содержат значительные количества промежуточных филаментов, которые остаются связанными с периферией ядра даже после удаления ядерных мембран.
В отличие от промежуточных филаментов ламины при полимеризации не образуют нитчатых структур, а организуются в сети с ортогональным типом укладки молекул. Такие сплошные решетчатые участки подстилают внутреннюю мембрану ядерной оболочки, могут разбираться при фосфорилировании ламинов и вновь полимеризоваться при их дефосфорилировании, что обеспечивает динамичность как этого слоя, так и всей ядерной оболочки.
Молекулярная характеристика белков внутриядерного остова детально еще не разработана. Показано, что в его состав входит ряд белков, принимающих участие в доменной организации ДНК в интерфазном ядре при создании розетковидной, хромомерной формы упаковки хроматина. Предположение относительно того, что элементы внутреннего матрикса представляют собой сердцевины розеточных структур хромомеров, находит подтверждение в том, что полипептидный состав матрикса интерфазных ядер (за исключением белков ламины) и остаточных структур метафазных хромосом (осевые структуры, или скэффолд) практически одинаковы. В обоих случаях эти белки отвечают за поддержание петлевой организации ДНК.

ДНК ядерного белкового матрикса
Рассматривая особенности ДНК, входящей в состав ядерного матрикса, необходимо еще раз подчеркнуть, что эта остаточная ДНК представлена в минимальном количестве (0,1—1% от сухой массы фракции) и составляет лишь менее 1% от всей ДНК ядра. Эта ДНК оказалась устойчивой к действию нуклеаз, вероятно, за счет ее существования в виде прочных ДНК-белковых комплексов.
Большой интерес представляет изучение фрагментов ДНК, входящих в состав ядерного матрикса. Расчеты показали, что в ядрах существует от 60000 до 125000 участков ДНК, защищенных от действия нуклеаз, и эти участки могут быть расположены на всех трех компонентах ядерного матркса.
Подробно изучена ДНК ядерного матрикса клеток асцитной карциномы Эрлиха мышей. Так, были обнаружены две размерные группы фрагментов ДНК в составе ядерного матрикса. В первую группу входили высокомолекулярные фрагменты размером около 10 т.п.н., они составляли всего 0,02% от исходного количества ДНК. Их число достигало примерно 100 на гаплоидный набор хромосом, т.е. всего 2-3 участка прикрепления ДНК к ядерному матриксу на хромосому. Эти фрагменты были обогащены сателлитной ДНК и связаны с ламиной. Функциональное значение этих участков может состоять в обеспечении фиксированного положения хромосом в ядре с помощью закрепления их определенных участков (центромер, теломер) на ламине.
Вторая группа фрагментов, связанных с матриксом, состояла из небольших участков ДНК (120—140 п.н.), гетерогенных по последовательности. Они встречаются между участками ДНК длиной около 50 т.н. п., представляющих собой, вероятно, петли основной массы хроматина (рис. 69). Функциональное значение второй группы этих коротких участков ДНК может заключаться в том, что они ассоциированы с белками, лежащими в сердцевинах розеткоподобных структур хроматина или в основании развернутых петель ДНК хроматина при его активации.
|
Рис. 69. Схема связи ДНК с компонентами ядерного белкового матрикса (по: Разин, Яровая, 1983) |
Сходные результаты были получены на многих объектах. Было обнаружено, что зоны (районы) связывания ДНК с матриксом (MAR - matrix attachment regions, или SAR - scaffold attachment regions) содержат приблизительно 200 п.н. и располагаются друг от друга на расстоянии 5-112 т.п.н. У дрозофилы на ядро приходится по крайней мере 10 000 таких MAR (или SАR)-областей.
Места расположения последовательностей SAR (MAR) очень сходны или даже идентичны с местами связывания ДНК с топоизомеразой II, которая играет основную структурную и ферментативную роль в образовании петель хроматина. Более того, один из белков матрикса (скэффолда) митотических хромосом (белок Scl) оказался просто топоизомеразой II. С помощью иммунофлуоресценции было показано, что на интерфазных хромосомах Scl локализуется в основании петель ДНК.
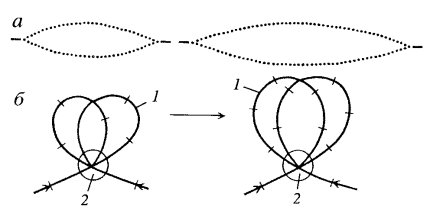
При изучении кинетики гидролиза вновь синтезированной ДНК нуклеазами было обнаружено, что ядерный матрикс связан с репликацией ДНК. Выявлено, что большая часть ДНК, содержащая радиоактивную метку, связана с матриксом: свыше 70% новосинтезированной ДНК было локализовано в зоне внутреннего ядерного матрикса. Это наблюдение давало основание считать, что на ядерном матриксе происходят инициация и собственно репликация ДНК. Фракция ДНК, ассоциированная с ядерным матриксом, оказалась обогащенной репликативными вилками. В составе ядерного матрикса обнаружена ДНК-полимераза α — основной фермент репликации ДНК. Кроме него с ядерным матриксом связаны и другие ферменты репликативного комплекса (реплисомы): ДНК-праймаза, ДНК-лигаза, ДНК-топоизомераза II. Высказана гипотеза о том, что репликация ДНК осуществляется таким образом, что петли ДНК как бы протягиваются через закрепленные в матриксе репликационные комплексы (рис. 70). Обнаружено, что участки начала репликации ДНК располагаются вблизи (или совпадают с ними) участков постоянного прикрепления ДНК к ядерному матриксу.
|
Рис. 70. Протаскивание петли растущей цепи ДНК (1) через репликационный комплекс (2) а — радиоавтографы ДНК; б — гипотетическая схема этого процесса |
В состав ядерного матрикса входит около 1% РНК, включающей в себя как гетерогенную высокомолекулярную РНК, так и рибосомную РНК и РНК ядерных малых РНП. На возможность связи элементов матрикса с процессами транскрипции указывали данные о том, что при коротком мечении матрикс обогащался быстро меченной гетерогенной РНК. Обнаружено, что в состав белков внутреннего ядерного матрикса входит РНК-полимераза II, ответственная за синтез информационных РНК. С ядерным матриксом клеток яйцеводов кур оказалась связанной большая часть (95%) новосинтезированных пре-мРНК овальбумина и пре-рРНК. Эти наблюдения привели к заключению, что ядерный матрикс может выполнять структурную роль в синтезе, процессинге и транспорте РНК в ядре.
С ядерным матриксом связаны собственно транскрибирующиеся гены. Транскрипционные комплексы закреплены на ядерном матриксе, а сама транскрипция осуществляется одновременно с перемещением матричной ДНК относительно закрепленных транскрипционных комплексов, содержащих РНК-полимеразу II. Кроме тРНК и ее предшественников в составе ядерного белкового матрикса обнаруживаются малые ядерные рибонуклеопротеиды (мяРНП), которые участвуют в созревании информационных РНК, в процессе сплайсинга (см. далее). Эти РНК-содержащие частицы, иногда называемые сплайсосомами, собраны в группы, или кластеры, связанные с белками ядерного матрикса.
Элементы ядерного матрикса могут прямо участвовать в регуляции транскрипции. Так, участки MAR обычно связаны с такими регуляторными последовательностями на ДНК, как энхансеры и сайленсеры, определяющими интенсивность транскрипционных процессов. На ядерном матриксе локализованы белки-рецепторы для ряда стероидных гормонов.
Относительно связи ДНК с элементами ядерного матрикса на сегодня сложились представления о том, что эта связь может отражать различные функциональные особенности. Например, связь ДНК с ламиной может отражать структурную, постоянную ассоциацию ДНК, а связь с внутренними элементами - функциональную, связанную как с синтезом ДНК, так и РНК.
Поведение белков ядерного матрикса во время митоза изучено еще недостаточно. О судьбе ламины при митозе уже было сказано: ее компоненты разбираются, частично переходя в цитоплазму, частично (ламин В) оставаясь в связи с мембранами. Относительно компонентов внутриядерного матрикса сведений меньше: известно, что часть этих белков входит в состав матрикса (скэффолда) митотических хромосом.

Величко В.В. © Copyright 2008.![]()
![]()