О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыМИТОТИЧЕСКОЕ ДЕЛЕНИЕ КЛЕТОК
Практический тест: митоз и мейоз

Общая организация митоза
Как постулирует клеточная теория, увеличение числа клеток происходит исключительно за счет деления исходной клетки, предварительно удвоившей свой генетический материал. Это — главное событие в жизни клетки как таковой, а именно завершение воспроизведения себе подобного. Вся «интерфазная» жизнь клеток направлена на полное осуществление клеточного цикла, заканчивающегося клеточным делением. Само же деление клетки — процесс неслучайный, строго генетически детерминированный, где в последовательный ряд выстроена целая цепочка событий.
|
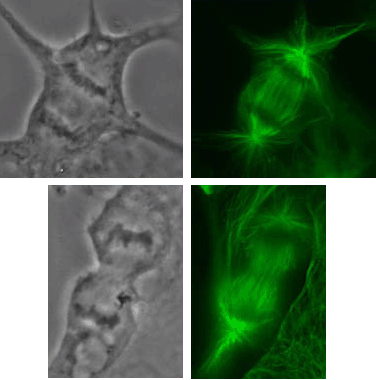
Деление клеток в культуре Vero |
Как уже указывалось, деление прокариотических клеток протекает без конденсации хромосом, хотя должен существовать ряд метаболических процессов и, в первую очередь, синтезов ряда специфических белков, участвующих в «простом» делении бактериальной клетки надвое.
Деление всех эукариотических клеток связано с конденсацией удвоенных (реплицированных) хромосом, которые приобретают вид плотных нитчатых структур. Эти нитчатые хромосомы переносятся в дочерние клетки специальной структурой — веретеном деления. Такой тип деления эукариотических клеток — митоз (от греч. mitos - нити), или кариокинез, или непрямое деление — является единственным полноценным способом увеличения числа клеток. Прямое деление клеток, или амитоз, достоверно описано только при делении полиплоидных макронуклеусов инфузорий, их микронуклеусы делятся только митотическим путем.
Деление всех эукариотических клеток связано с образованием специального аппарата клеточного деления. При удвоении клеток происходят два события: расхождение реплицированных хромосом и разделение клеточного тела — цитотомия. Первая часть события у эукариот осуществляется с помощью так называемого веретена деления, состоящего из микротрубочек, а вторая часть происходит за счет участия актомиозиновых комплексов, вызывающих образование перетяжки у клеток животного происхождения или за счет участия микротрубочек и актиновых филаментов в образовании фрагмопласта, первичной клеточной перегородки у клеток растений.
В образовании веретена деления у всех эукариотических клеток принимают участие два рода структур: полярные тельца (полюсы) веретена и кинетохоры хромосом. Полярные тельца, или центросомы, являются центрами организации (или нуклеации) микротрубочек. От них своими плюс-концами отрастают микротрубочки, образующие пучки, тянущиеся к хромосомам. У клеток животных центросомы включают в свой состав и центриоли. Но у многих эукариот центриолей нет, а центры организации микротрубочек присутствуют в виде бесструктурных аморфных зон, от которых отходят многочисленные микротрубочки. Как правило, при организации аппарата деления участвуют две центросомы или два полярных тельца, находящиеся на противоположных концах сложного, веретенообразного тела, состоящего из микротрубочек. Второй структурой, характерной для митотического деления клеток, связывающей микротрубочки веретена с хромосомой, являются кинетохоры. Именно кинетохоры, взаимодействуя с микротрубочками, ответственны за перемещение хромосом при клеточном делении.
Все эти компоненты, а именно: полярные тельца (центросомы), микротрубочки веретена и кинетохоры хромосом, встречаются у всех эукариотических клеток, начиная с дрожжей и кончая млекопитающими, и обеспечивают сложный процесс расхождения реплицированных хромосом.

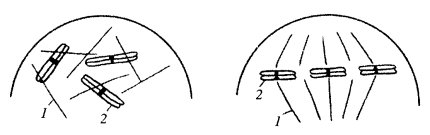
Различные типы митоза эукариот
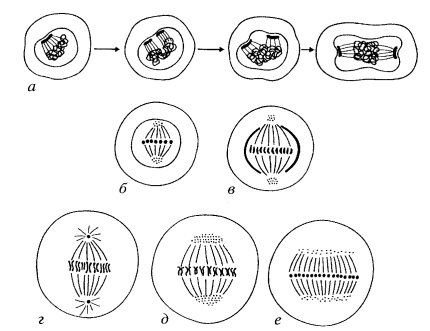
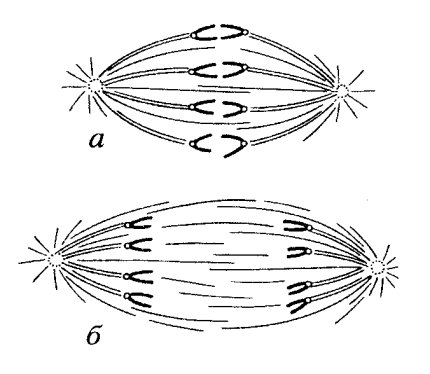
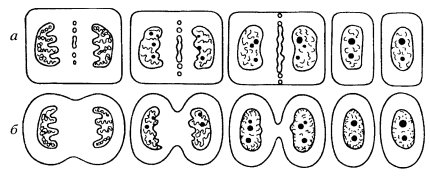
Описанное выше деление клеток животных и растений — не единственная форма непрямого деления клеток (рис. 299). Наиболее простой тип митоза — плевромитоз. Он в какой-то степени напоминает бинарное деление прокариотических клеток, у которых нуклеоиды после репликации остаются связанными с плазматической мембраной, которая начинает как бы расти между точками связывания ДНК и тем самым как бы разносит хромосомы в разные участки клетки (о делении прокариот см. далее). После этого при образовании клеточной перетяжки каждая из молекул ДНК окажется в новой отдельной клетке.
|
Рис. 299. Типы митотического деления клеток эукариотических организмов а — плевромитоз дрожжевой клетки; б — ортомитоз закрытый; в — ортомитоз полузакрытый; г-е — ортомитоз открытый: г — митоз животной клетки, д — митоз клетки высших растений, е — митоз амебы |
Как уже говорилось, характерным для деления эукариотических клеток является образование веретена, построенного из микротрубочек (рис. 300). При закрытом плевромитозе (закрытым он называется потому, что расхождение хромосом происходит без нарушения ядерной оболочки) в качестве центров организации микротрубочек (ЦОМТ) участвуют не центриоли, а другие структуры, находящиеся на внутренней стороне ядерной мембраны. Это так называемые полярные тельца неопределенной морфологии, от которых отходят микротрубочки. Этих телец два, они расходятся друг от друга, не теряя связи с ядерной оболочкой, и в результате этого образуются два полу веретена, связанные с хромосомами. Весь процесс образования митотического аппарата и расхождения хромосом происходит в этом случае под ядерной оболочкой. Такой тип митоза встречается среди простейших, он широко распространен у грибов (хитридиевые, зигомицеты, дрожжи, оомицеты, аскомицеты, миксомицеты и др.). Встречаются формы полузакрытого плевромитоза, когда на полюсах сформированного веретена ядерная оболочка разрушается.
|
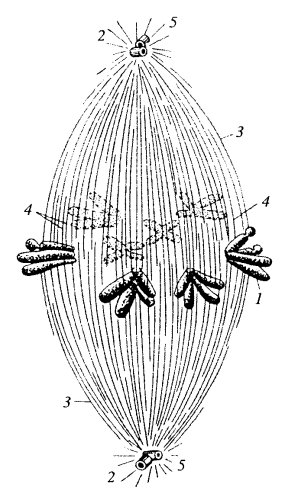
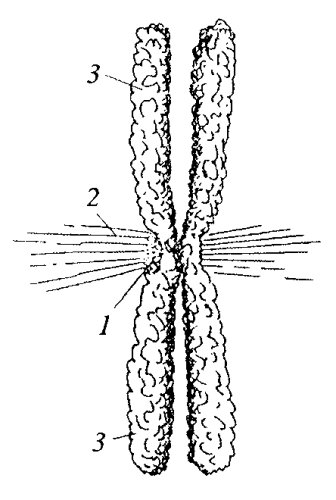
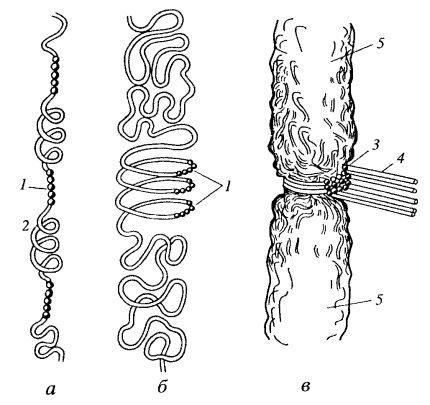
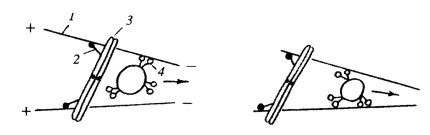
Рис. 300. Схема строения веретена деления 1 — хромосомы; 2 — полюса веретена, центросомы; 3 — межполюсные микротрубочки; 4 — кинетохорные микротрубочки; 5 — астральные микротрубочки |
Другой формой митоза является ортомитоз. В этом случае ЦОМТ располагаются в цитоплазме, с самого начала идет образование не полуверетен, а двухполюсного веретена. Существуют три формы ортомитоза: открытый (обычный митоз), полузакрытый и закрытый. При полузакрытом ортомитозе образуется бисимметричное веретено с помощью расположенных в цитоплазме ЦОМТ, ядерная оболочка сохраняется в течение всего митоза, за исключением полярных зон. В качестве ЦОМТ здесь могут обнаруживаться массы гранулярного материала или даже центриоли. Эта форма митоза встречается у зооспор зеленых, бурых, красных водорослей, у некоторых низших грибов и грегарин. При закрытом ортомитозе полностью сохраняется ядерная оболочка, под которой образуется настоящее веретено. Микротрубочки формируются в кариоплазме, реже отрастают от внутриядерного ЦОМТ, не связанного (в отличие от плевромитоза) с ядерной оболочкой. Такого типа митозы характерны для деления микронуклеусов инфузорий, но встречаются и у других простейших. При открытом ортомитозе ядерная оболочка полностью распадается. Этот тип деления клеток характерен для животных организмов, некоторых простейших и для клеток высших растений. Эта форма митоза в свою очередь представлена астральным и анастральным типами (рис. 301).
|
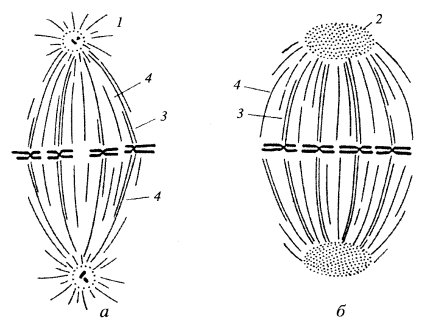
Рис. 301. Астральный (а) и анастральный (б) типы веретена деления в метафазе открытого ортомитоза 1 — астер - лучистое сияние вокруг центриолей на полюсе веретена; 2 — аморфная полярная «шапочка» на полюсе веретена; 3 — кинетохорные микротрубочки; 4 — межполюсные микротрубочки |
Из этого краткого рассмотрения видно, что главной особенностью митоза вообще является возникновение структур веретена деления, образующегося в связи с разнообразными по своему строению ЦОМТ.

Морфология митотической фигуры
Как уже говорилось, митотический аппарат наиболее подробно изучен у клеток высших растений и животных. Особенно хорошо он бывает выражен на стадии метафазы митоза (см. рис. 300). В живых или фиксированных клетках в метафазе в экваториальной плоскости клетки располагаются хромосомы, от которых в противоположных на правлениях тянутся так называемые нити веретена, сходящиеся на двух разных полюсах митотической фигуры. Так что митотическое веретено — это совокупность хромосом, полюсов и волокон. Волокна веретена представляют собой одиночные микротрубочки или их пучки. Начинаются микротрубочки от полюсов веретена, и часть из них на правляется к центромерам, где расположены кинетохоры хромосом (кинетохорные микротрубочки), часть проходит дальше по направлению к противоположному полюсу, но до него не доходит — «межполюсные микротрубочки». Кроме того, от полюсов отходит группа радиальных микротрубочек, образуя вокруг них как бы «лучистое сияние» — это астральные микротрубочки.
По общей морфологии митотические фигуры делятся на два типа: астральный и анастральный (см. рис. 301).
Астральный тип веретена (или конвергентный) характеризуется тем, что его полюсы представлены небольшой зоной, к которой сходятся (конвергируют) микротрубочки. Обычно в полюсах астральных веретен располагаются центросомы, содержащие центриоли. Хотя известны случаи бесцентриолярных астральных митозов (при мейозе некоторых беспозвоночных). От полюсов, кроме того, расходятся радиальные микротрубочки, не входящие в состав веретена, а образующие звездчатые зоны — цитастеры. В целом же такой тип митотического веретена напоминает скорее гантель (см. рис. 301, а).
Анастральный тип митотической фигуры не имеет на полюсах цитастеров. Полярные области веретена здесь широкие, их называют полярными шапочками, в их состав не входят центриоли. Волокна веретена в данном случае не отходят от одной точки, а расходятся широким фронтом (дивергируют) от всей зоны полярных шапочек. Этот тип веретена характерен для делящихся клеток высших растений, хотя иногда встречается и у высших животных. Так, в раннем эмбриогенезе млекопитающих при делении созревания ооцита и при I и II делении зиготы наблюдаются бесцентриолярные (дивергентные) митозы. Но уже начиная с третьего клеточного деления и во всех последующих клетки делятся при участии астральных веретен, в полюсах которых всегда обнаруживаются центриоли.
В целом же для всех форм митоза общими структурами остаются хромосомы с их кинетохорами, полярные тельца (центросомы) и волокна веретена.

Центромеры и кинетохоры
Центромеры как участки связывания хромосом с микротрубочками могут иметь различную локализацию по длине хромосом. Например, голоцентрические центромеры встречаются в том случае, когда микротрубочки связываются по длине всей хромосомы (некоторые насекомые, нематоды, некоторые растения), а моноцентрические центромеры — когда микротрубочки связаны с хромосомами в одном участке (рис. 302). Моноцентрические центромеры могут быть точечными (например, у некоторых почкующихся дрожжей), когда к кинетохору подходит всего лишь одна микротрубочка, и зональными, где к сложному кинетохору подходит пучок микротрубочек. Несмотря на разно образие зон центромер, все они связаны со сложной структурой кинетохора, имеющего принципиальное сходство строения и функций у всех эукариот.
|
Рис. 302. Кинетохоры в центромерном районе хромосом 1 — кинетохор; 2 — пучок кинетохорных микротрубочек; 3 — хроматида |
Проще всего строение моно центрического кинетохора у клеток пекарских дрожжей (Saccharomyces cerevisiae). Он связан со специальным участком ДНК на хромосоме (центромерный или CEN-локус). Этот участок состоит из трех элементов ДНК: CDE I, CDE II, CDE III. Интересно, что последовательности нуклеотидов в CDE I и CDE III очень консервативны и сходны с таковыми у дрозофиллы. Участок CDE II может быть разной величины и обогащен А—Т-парами. За связь с микротрубочками у S. cerevisia отвечает участок CDE III, взаимодействующий с целым рядом белков.
Зональные центромеры состоят из многократно повторяющихся CEN-локусов, обогащенных участками конститутивного гетерохроматина, содержащего сателлитную ДНК, связанную с кинетохорами.
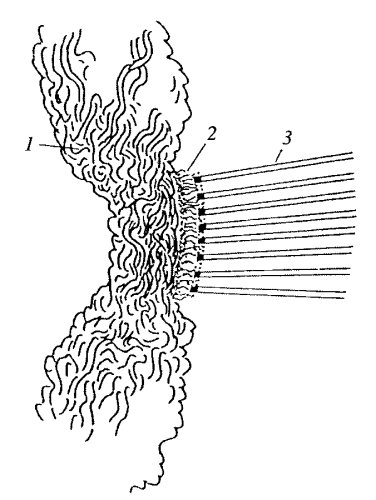
Кинетохоры — специальные белковые структуры, большей частью располагающиеся в зонах центромер хромосом (см. рис. 302). Кинетохоры лучше изучены у высших организмов. Кинетохоры — это сложные комплексы, состоящие из многих белков. Морфологически они очень сходны, имеют одинаковое строение, начиная от диатомовых водорослей, кончая человеком. Кинетохоры представляют собой трехслойные структуры (рис. 303): внутренний плотный слой, примыкающий к телу хромосомы, средний рыхлый слой и внешний плотный слой. От внешнего слоя отходят множество фибрилл, образуя так называемую фиброзную корону кинетохора (рис. 304).
|
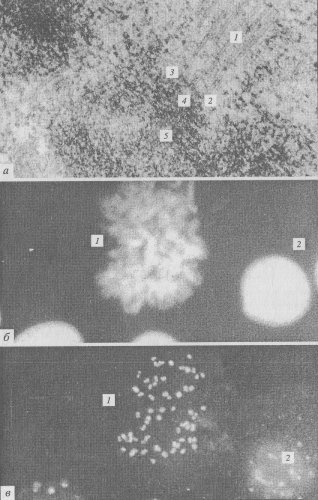
Рис. 303. Микрофотографии кинетохора, полученные с помощью электронного микроскопа а — кинетохор метафазной хромосомы клетки культуры СПЭВ: 1 — микротрубочки, 2 — внешний слой, 3 — промежуточная зона, 4— внутренний слой, 5 — хромосома; б — окраска клеток культуры СПЭВ ядерным флуорохромом Dapi (фото И.С. Кудрявцева): 1 — хромосомы делящейся клетки, 2 — интерфазные ядра; в — окраска тех же клеток антителами к кинетохорному белку CENP-A. Видны двойные светящиеся точки в центромерах хромосом (1) и в интерфазных ядрах (2) (фото И.С. Кудрявцева) |
|
Рис. 304. Схема ультраструктуры кинетохора 1 — анафазная хроматида; 2 — трехслойный кинетохор; 3 — кинетохорные микротрубочки |
В общей форме кинетохоры имеют вид пластинок или дисков, лежащих в зоне первичной перетяжки хромосомы, в центромере. На каждую хроматиду (хромосому) обычно приходится по одному кинетохору. До анафазы кинетохоры на каждой сестринской хроматиде располагаются оппозитно, связываясь каждый со своим пучком микротрубочек. У некоторых растений кинетохор имеет вид не пластинок, а полусфер.
Кинетохоры представляют собой сложные комплексы, где кроме специфической ДНК участвует множество кинетохорных белков (CENP-белки) (рис. 305). В участке центромеры хромосомы под трехслойным кинетохором расположен участок гетерохроматина, обогащенного α-сателлитной ДНК. Здесь же обнаруживается ряд белков: CENP-B, который связывается с α-ДНК; МСАК — кинезиноподобный белок; a также белки, ответственные за спаривание сестринских хромосом (когезины). Во внутреннем слое кинетохора выявлены следующие белки: CENP-A — вариант гистона НЗ, который, вероятно, связывается с CDE II участком ДНК; CENP-G, связывающийся с белками ядерного матрикса; консервативный белок CENP-C, с неизвестной пока функцией. В среднем рыхлом слое обнаружен белок 3F3/2, который, по-видимому, как-то регистрирует натяжение пучков микротрубочек. Во внешнем плотном слое кинетохора выявлены белки CENP-E и CENP-F, участвующие в связывании микротрубочек. Кроме того, здесь имеются белки семейства цитоплазматических динеинов.
|
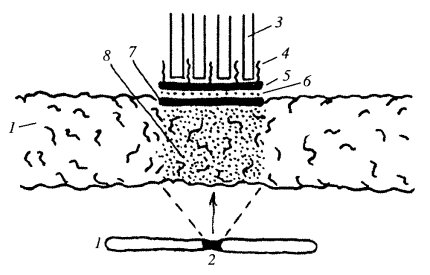
Рис. 305. Схема локализация центромерных белков и ДНК 1 — хромосома; 2 — центромера; 3 — микротрубочки; 4 — фиброзная корона: CENP-E, динейны; 5 — внешний слой: CENP-E, CENP-F; 6 — промежуточная зона; 7 — внутренний слой: CENP-C, ДНК; 8 — центромерный гетсрохроматин: α-сателлитная ДНК, CENP-B, МСАК, INCENP (когезин) |
Функциональная роль кинетохоров заключается в связывании между собой сестринских хроматид, в закреплении митотических микротрубочек, в регуляции разъединения хромосом и в собственно движении хромосом во время митоза при участии микротрубочек.
К кинетохорам подходят микротрубочки, растущие от полюсов, от центросом. Минимальное их число у дрожжей — одна микротрубочка на каждую хромосому. У высших растений это число достигает 20-40. В последнее время удалось показать, что сложные кинетохоры высших организмов представляют собой структуру, состоящую из повторяющихся субъединиц, каждая из которых способна образовывать связи с микротрубочками (рис. 306). По одной из моделей строения центромерного участка хромосомы (Зинковски, Мейне, Бринкли, 1991) предложено, что в интерфазе на специфических участках ДНК расположены субъединицы кинетохора, содержащие все характерные белки. По мере конденсации хромосом в профазе эти субъединицы группируются таким образом, что создается зона, обогащенная этими белковыми комплексами, — кинетохор.
|
Рис. 306. Модель строения кинетохора (по: Zinkowski et al., 1991) а — деконденсированная центромера; 6 — частично конденсированная центромера; в — полностью конденсированная центромера. 1 — участок ДНК с белковыми сегментами, связывающими микротрубочки; 2 — линкерный участок ДНК; 3 — сформированный кинетохор; 4 — микротрубочки; 5 — плечи хромосом |
Кинетохоры, белковые в общем структуры, удваиваются в S-периоде, параллельно удвоению хромосом. Но их белки присутствуют на хромосомах во всех периодах клеточного цикла (см. рис. 303).

Динамика митоза
Во многих разделах данной книги мы уже касались поведения различных клеточных компонентов (хромосом, ядрышек, ядерной оболочки и др.) при клеточном делении. Но вернемся кратко к этим важнейшим процессам, чтобы разобраться в них уже в целом.
У клеток, вступивших в цикл деления, фаза собственно митоза, непрямого деления, занимает относительно короткое время, всего около 0,1 времени клеточного цикла. Так, у делящихся клеток меристемы корней интерфаза может составлять 16—30 ч, а митоз занимать всего 1—3 ч. Цикл эпителиальных клеток кишечника мыши длится около 20—22 ч, на митоз же приходится всего 1 ч. При дроблении яйцеклеток весь клеточный период, включая митоз, может быть меньше часа.
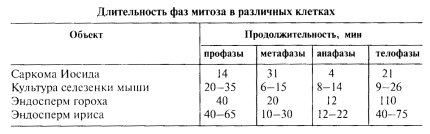
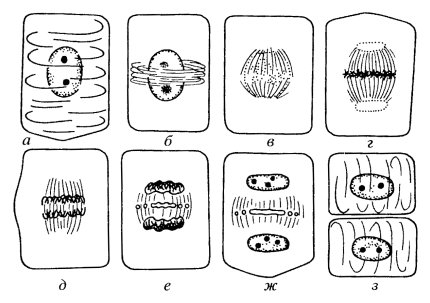
Процесс митотического деления клеток принято подразделять на несколько основных фаз: профаза, прометафаза, метафаза, анафаза, телофаза (рис. 307-312). Границы между этими фазами установить точно очень трудно, потому что сам митоз представляет собой непрерывный процесс и смена фаз происходит очень постепенно: одна их них незаметно переходит в другую. Единственная фаза, которая имеет реальное начало, это анафаза — начало движения хромосом к полюсам. Длительность отдельных фаз митоза различна, наиболее короткая по времени анафаза (табл. 15).
|
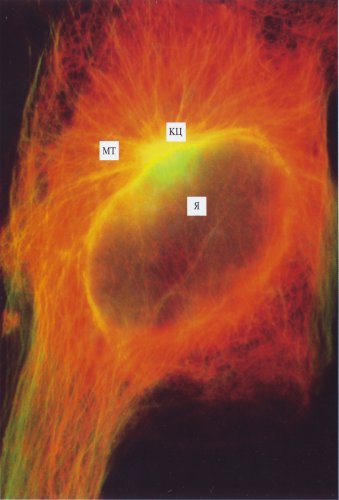
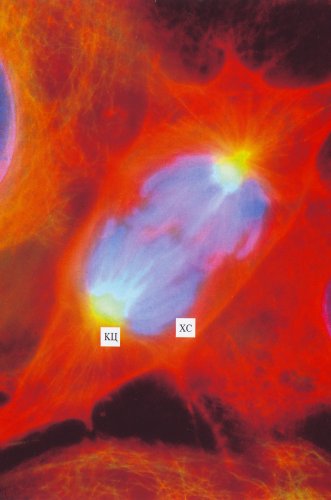
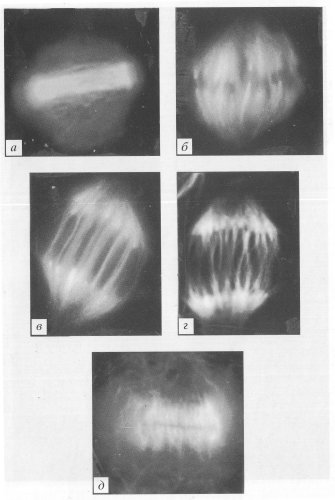
Рис. 307. Интерфазная клетка культуры легочной ткани тритона (фото А.Л. Ходякова) МТ — микротрубочки (желтые), окрашенные мечеными антителами к тубулину; КЦ — клеточный центр; Я — ядро |
|
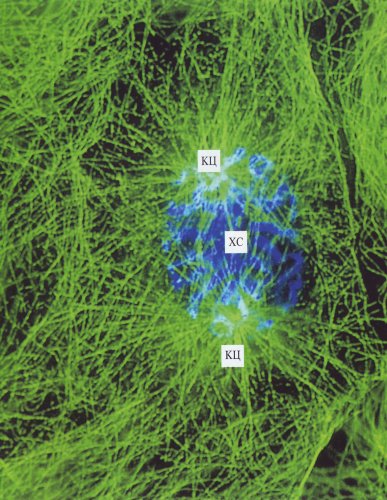
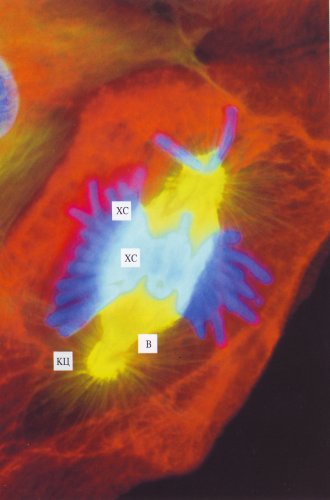
Рис. 308. Митотические клетки культуры легочной ткани тритона в профазе (фото А.Л. Ходякова) Видны расходящиеся клеточные центры (КЦ). Зеленым цветом обозначены микротрубочки, окрашенные антителами к тубулину, голубым — хромосомы (ХС), окрашенные флуорохромом |
|
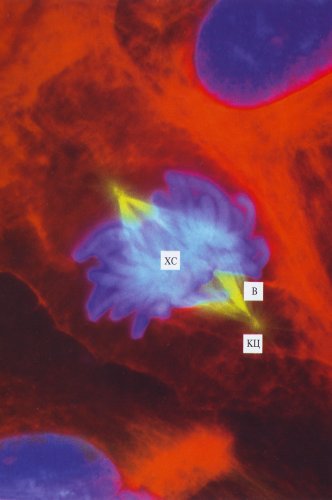
Рис. 309. Митотические клетки культуры легочной ткани тритона в метафазе (фото А.Л. Ходякова) Микротрубочки веретена (В) и клеточные центры (КЦ) обозначены желтым цветом, хромосомы (ХС) голубые, красным обозначены промежуточные филаменты |
|
Рис. 310. Митотические клетки культуры легочной ткани тритона в анафазе (фото А.Л. Ходякова) Обозначения см. рис. 309 |
|
Рис. 311. Митотические клетки культуры легочной ткани тритона в ранней телофазе (фото А.Л. Ходякова) Обозначения см. рис. 309 |
|
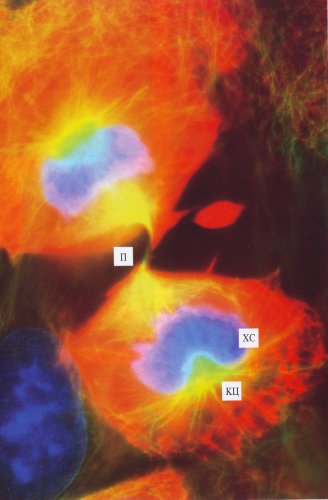
Рис. 312. Митотические клетки культуры легочной ткани тритона в поздней телофазе (цитотомия) (фото А. Л. Ходякова) П — перетяжка. Остальные обозначения см. рис. 309 |
Таблица 15 |
Длительность фаз митоза в различных клетках |
|
Определяется время отдельных фаз митоза лучше всего при прямом наблюдении за делением живых клеток в специальных камерах. Зная время митоза, можно рассчитать длительность отдельных фаз по проценту их встречаемости среди делящихся клеток.
Профаза. Уже в конце G2-периода в клетке начинают происходить значительные перестройки. Точно определить, когда наступает профаза, невозможно. Лучшим критерием для начала этой фазы митоза может служить появление в ядрах нитчатых структур — митотических хромосом. Этому событию предшествует повышение активности фосфорилаз, модифицирующих гистоны, в первую очередь, гистон H1. В профазе сестринские хроматиды связаны друг с другом бок о бок с помощью белков-когезинов, которые образуют эти связи еще в S-периоде, во время удвоения хромосом. К поздней профазе связь между сестринскими хроматидами сохраняется только в зоне кинетохоров. В профазных хромосомах уже можно наблюдать зрелые кинетохоры, которые не имеют никаких связей с микротрубочками.
Конденсация хромосом в профазном ядре совпадает с резким уменьшением транскрипционной активности хроматина, которая полностью исчезает к середине профазы. В связи с падением синтеза РНК и конденсацией хроматина происходит инактивация и ядрышковых генов. При этом отдельные фибриллярные центры сливаются так, что превращаются в ядрышкообразующие участки хромосом, в ядрышковые организаторы. Большая часть ядрышковых белков диссоциирует и в свободном виде встречается в цитоплазме клетки или связывается с поверхностью хромосом.
Одновременно с этим происходит фосфорилирование ряда белков ламины — ядерной оболочки, которая распадается. При этом теряется связь ядерной оболочки с хромосомами. Затем ядерная оболочка фрагментируется на мелкие вакуоли, а поровые комплексы исчезают.
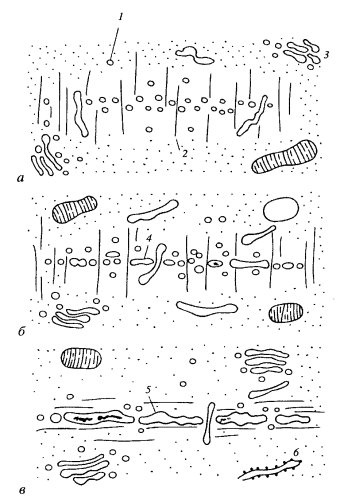
Параллельно этим процессам наблюдается активация клеточных центров. В начале профазы разбираются микротрубочки в цитоплазме и начинается бурный рост множества астральных микротрубочек вокруг каждой из удвоившихся диплосом (рис. 308). Скорость роста микротрубочек в профазе почти в два раза выше роста интерфазных микротрубочек, но лабильность их в 5—10 раз выше цитоплазматических. Так, если время полужизни микротрубочек в цитоплазме составляет около 5 мин, то во время первой половины митоза — всего лишь 15 с. Здесь еще в большей степени проявляется динамическая нестабильность микротрубочек. Все микротрубочки, отходящие от центросом, растут вперед своими плюс-концами.
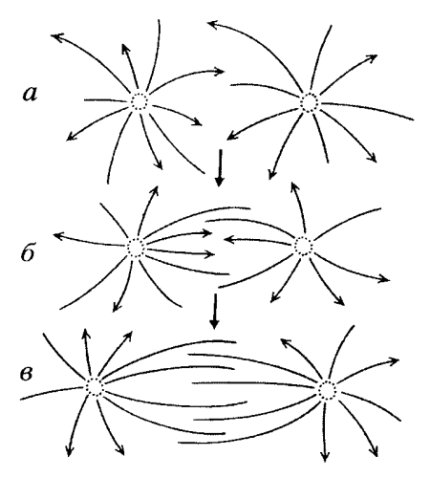
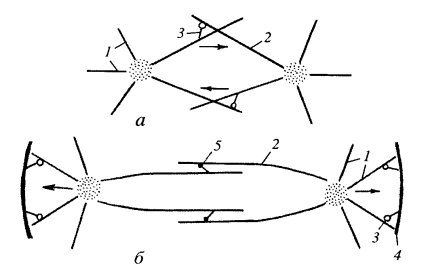
Активированные центросомы — будущие полюсы веретена деления — начинают расходиться друг от друга на некоторое расстояние. Механизм такого профазного расхождения полюсов заключается в следующем: идущие навстречу друг другу антипараллельные микротрубочки взаимодействуют между собой, что приводит к их большей стабилизации и расталкиванию полюсов (рис. 313). Это происходит за счет взаимодействия с микротрубочками динеиноподобных белков, которые в центральной части веретена выстраивают межполюсные микротрубочки параллельно друг другу. Одновременно с этим продолжаются их полимеризация и рост, которые сопровождаются их расталкиванием в направлении к полюсам за счет работы кинезиноподобных белков (рис. 314). В это время при образовании веретена микротрубочки с кинетохорами хромосом еще не связаны.
|
Рис. 313. Механизм расталкивания полюсов за счет стабилизации антипараллельных микротрубочек, отходящих от разных полюсов Профаза: а — ранняя, 6 — средняя, в — поздняя. Стрелки указывают направление роста микротрубочек, их (+)-концы |
|
Рис. 314. Участие моторных белков в расталкивании полюсов и образовании веретена а — ранняя стадия: 1 — астральные микротрубочки (МТ), 2 — межполюсные МТ, 3 — динеинподобные белки; б — поздняя стадия: 4 — плазматическая мембрана, 5 — кинезины |
В профазе одновременно с разборкой цитоплазматических микротрубочек происходит дезорганизация эндоплазматического ретикулума (он распадается на мелкие вакуоли, лежащие по периферии клетки) и аппарата Гольджи, который теряет свою околоядерную локализацию, разделяются на отдельные диктиосомы, беспорядочно разбросанные в цитоплазме.
Прометафаза. После разрушения ядерной оболочки митотические хромосомы без особого порядка лежат в зоне бывшего ядра. В прометафазе начинаются их движение и перемещение, которые в конечном итоге приводят к образованию экваториальной хромосомной «пластинки», к упорядоченному расположению хромосом в центральной части веретена уже в метафазе. В прометафазе наблюдается постоянное движение хромосом, или метакинез, при котором они то приближаются к полюсам, то уходят от них к центру веретена, пока не займут среднее положение, характерное для метафазы (конгрессия хромосом).
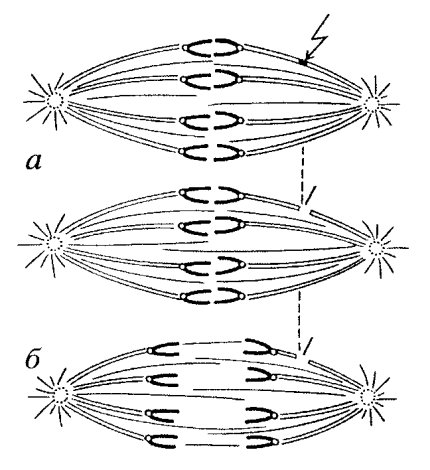
В начале прометафазы хромосомы, лежащие ближе к одному из полюсов образующегося веретена, начинают быстро к нему приближаться. Это происходит не одномоментно, а занимает определенное время. Найдено, что такой первичный асинхронный дрейф хромосом к разным полюсам осуществляется с помощью микротрубочек. Используя видеоэлектронное усиление фазового контраста в световом микроскопе, удалось на живых клетках наблюдать, что отдельные отходящие от полюсов микротрубочки случайно достигают одного из кинетохоров хромосомы и связываются с ним, «захватываются» кинетохором. После этого происходит быстрое, со скоростью около 25 мкм/мин, скольжение хромосомы вдоль микротрубочки по направлению к её минус-концу. Это приводит к тому, что хромосома приближается к полюсу, от которого произошла эта микротрубочка (рис. 315). Важно отметить, что кинетохоры могут контактировать с боковой поверхностью таких микротрубочек. Во время такого движения хромосомы микротрубочки не разбираются. Вероятнее всего, что за такое быстрое перемещение хромосом отвечает моторный белок, аналогичный цитоплазматическому динеину, обнаруженному в короне кинетохоров.
|
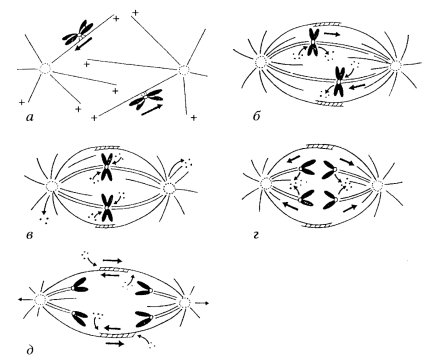
Рис. 315. Схема митотических движений хромосом а — профаза: дрейф сдвоенных хроматид к полюсам веретена; б — прометафаза: дрейф сдвоенных хроматид в экваториальную область веретена; в — метафаза; г — анафаза А: расхождение хроматид к полюсам; д — анафаза Б: расхождение полюсов. Тонкие стрелки показывают поток мономеров тубулина; толстые стрелки указывают направление движения хромосом |
В результате такого первичного прометафазного движения хромосомы оказываются случайным образом приближены к полюсам веретена, где продолжает происходить образование новых микротрубочек. Очевидно, что чем ближе к центросоме будет находиться хромосомный кинетохор, тем будет выше случайность его взаимодействия с другими микротрубочками. В этом случае новые, растущие плюс-концы микротрубочек «захватываются» зоной короны кинетохора; теперь с кинетохором оказывается связанным пучок из микротрубочек, рост которых продолжается на их плюс-конце. При росте такого пучка кинетохор, а вместе с ним и хромосома, должен перемещаться к центру веретена, удаляться от полюса. Но к этому времени от противоположного полюса ко второму кинетохору другой сестринской хроматиды подрастают свои микротрубочки, пучок которых начинает тянуть хромосому к противоположному полюсу. Наличие такой тянущей силы доказывается тем, что если лазерным микролучом перерезать пучок микротрубочек у одного из кинетохоров, то хромосома начинает двигаться к противоположному полюсу (рис. 316). В нормальных же условиях хромосома, совершая небольшие перемещения в сторону то одного, то другого полюса, в результате постепенно занимает срединное положение в веретене. В процессе прометафазного дрейфа хромосом происходит удлинение, наращивание микротрубочек на плюс-концах, когда кинетохор движется от полюса, и разборка, укорачивание микротрубочек тоже на плюс-конце, когда сестринский кинетохор движется по направлению к полюсу.
|
Рис. 316. Динамическая нестабильность локализации хромосом в прометафазе Перерезка пучка кинетохорных микротрубочек (показано стрелкой) вызывает движение хромосом к противоположному полюсу. а — исходная позиция хромосом; б — позиция хромосом после перерезки |
Эти переменные движения хромосом то туда, то сюда приводят к тому, что они в конце концов оказываются в экваторе веретена и выстраиваются в метафазную пластинку (см. рис. 315).
Метафаза (рис. 309). В метафазе, также как и в других фазах митоза, несмотря на некоторую стабилизацию пучков микротрубочек, продолжается их постоянное обновление за счет сборки и разборки тубулинов. Во время метафазы хромосомы располагаются так, что их кинетохоры обращены к противоположным полюсам. В это же время происходит постоянная переборка и межполюсных микротрубочек, число которых в метафазе достигает максимума. Если на метафазную клетку посмотреть со стороны полюса, то можно видеть, что хромосомы располагаются так, что их центромерные участки обращены к центру веретена, а плечи — к периферии. Такое расположение хромосом носит название «материнской звезды» и характерно для клеток животных (рис. 317). У растений часто в метафазе хромосомы лежат в экваториальной плоскости веретена без строгого порядка.
|
Рис. 317. Вид метафазной хромосомной пластинки саламандры с полюса |
К концу метафазы завершается процесс обособления друг от друга сестринских хроматид. Их плечи лежат параллельно друг другу, между ними хорошо видна их разделяющая щель. Последним местом, где контакт между хроматидами сохраняется, является центромера; вплоть до самого конца метафазы хроматиды во всех хромосомах остаются связанными в центромерных участках.
Анафаза начинается внезапно, что хорошо можно наблюдать при витальном исследовании. Анафаза начинается с разъединения всех сразу хромосом в центромерных участках. В это время происходит одновременная деградация центромерных когезинов, которые связывали до этого времени сестринские хроматиды. Такое одновременное отделение хроматид позволяет начать их синхронное расхождение. Хромосомы все вдруг теряют центромерные связки и синхронно начинают удаляться друг от друга по направлению к противоположным полюсам веретена (рис. 310 и 318). Скорость движения хромосом равномерная, она может достигать 0,5—2 мкм/мин. Анафаза — самая короткая стадия митоза (несколько процентов от всего времени), но за это время происходит целый ряд событий. Главными из них являются сегрегация двух идентичных наборов хромосом и транспорт их в противоположные концы клетки.
|
Рис. 318. Анафазное расхождение хромосом а — анафаза А; 6 — анафаза В |
При движении хромосомы меняют свою ориентацию и часто принимают V-образную форму. Вершина их направлена в сторону полюсов деления, а плечи как бы откинуты к центру веретена. Если перед анафазой произошел разрыв плеча хромосомы, то во время анафазы оно не будет участвовать в движении хромосом и останется в центральной зоне. Эти наблюдения показали, что именно центромерный участок вместе с кинетохором отвечает за движение хромосом. Созда ется впечатление, что за центромеру хромосома оттягивается к полюсу. У некоторых высших растений (ожика) нет выраженной центромерной перетяжки, и волокна веретена контактируют со многими точками на поверхности хромосом (полицентрические и голоцентрические хромосомы). В этом случае хромосомы располагаются поперек волокон веретена.
Собственно расхождение хромосом слагается из двух процессов: 1 — расхождение хромосом за счет кинетохорных пучков микротрубочек; 2 — расхождение хромосом вместе с полюсами за счет удлинения межполюсных микротрубочек. Первый из этих процессов носит название «анафаза А», второй — «анафаза В» (см. рис. 318).
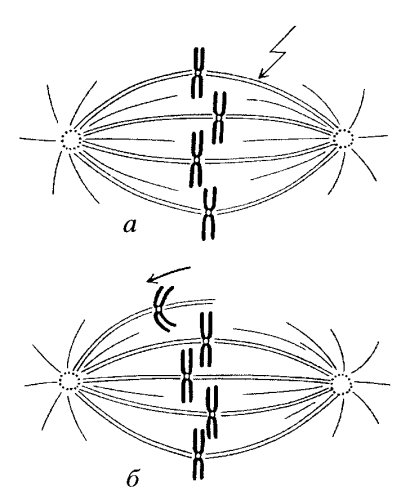
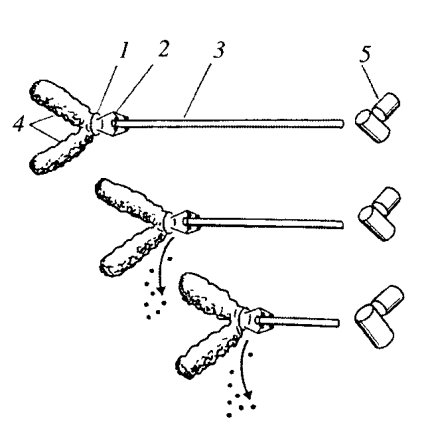
Во время анафазы А, когда группы хромосом начинают двигаться по направлению к полюсам, происходит укорачивание кинетохорных пучков микротрубочек. Можно было ожидать, что в этом случае деполимеризация микротрубочек должна осуществляться на их минус-концах, т.е. концах, ближайших к полюсу. Однако было доказано, что микротрубочки действительно разбираются, но большей частью (80%) с плюс-концов, прилежащих к кинетохорам. В эксперименте в живые клетки культуры ткани с помощью метода микроинъекции был введен тубулин, связанный с флуорохромом. Это позволяло витально видеть микротрубочки в составе веретена деления. В начале анафазы пучок веретена одной из хромосом был облучен световым микролучом примерно посередине между полюсом и хромосомой. При таком воздействии исчезает флуоресценция в облученном месте. Наблюдения показали, что облученный участок к полюсу не приближается, но хромосома достигает его при укорачивании кинетохорного пучка (рис. 319). Следовательно, разборка микротрубочек кинетохорного пучка происходит в основном с плюс-конца, в месте его соединения с кинетохором, а хромосома движется по направлению к минус-концу микротрубочек, который расположен в зоне центросомы. Оказалось, что такое движение хромосом зависит от присутствия АТФ и от наличия достаточной концентрации ионов Са2+. То, что в составе короны кинетохора, в которую вмонтированы плюс-концы микротрубочек, обнаружен белок динеин, позволило считать, что именно он является мотором, который подтягивает хромосому к полюсу. Одновременно с этим происходит деполимеризация кинетохорных микротрубочек на плюс-конце (рис. 320).
|
Рис. 319. Расхождение хромосом в анафазе, обусловленное деполимеризацией микротрубочек в районе кинетохоров а — обесцвечивание пучка флуоресцирующих микротрубочек (показано стрелкой); б — хромосома приближается к облученному участку |
|
Рис. 320. Схема участия динеиновых молекул в подтягивании хромосомы к полюсу при одновременной разборке микротрубочек (указано стрелками) 1 — кинетохор; 2 — динеиновые ручки; 3 — микротрубочка; 4 — плечи хромосомы; 5 — клеточный центр |
После остановки хромосом у полюсов наблюдается дополнительное их расхождение за счет удаления полюсов друг от друга (анафаза В). Показано, что при этом происходит наращивание плюс-концов межполюсных микротрубочек, которые могут значительно увеличиваться в длину. Взаимодействие между этими антипараллельными микротрубочками, приводящее к их скольжению друг относительно друга, определяется другими моторными кинезинподобными белками. Кроме того, полюса дополнительно подтягиваются к периферии клетки за счет взаимодействия с астральными микротрубочками динеиноподобных белков на плазматической мембране.
Последовательность анафаз А и В и их вклад в процесс расхождения хромосом могут быть различными у разных объектов. Так, у млекопитающих стадии А и В протекают практически одновременно. У простейших анафаза В может приводить к 15-кратному увеличению длины веретена. В растительных клетках стадия В отсутствует.
Телофаза начинается с остановки хромосом (ранняя телофаза, поздняя анафаза) (рис. 311 и 312) и кончается началом реконструкции нового интерфазного ядра (ранний G1-период) и разделением исходной клетки на две дочерние (цитокинез).
В ранней телофазе хромосомы, не меняя своей ориентации (центромерные участки — к полюсу, теломерные — к центру веретена), начинают деконденсироваться и увеличиваться в объеме. В местах их контактов с мембранными пузырьками цитоплазмы начинает строиться новая ядерная оболочка, которая раньше всего образуется на латеральных поверхностях хромосом и позже — в центромерных и теломерных участках. После замыкания ядерной оболочки начинается формирование новых ядрышек. Клетка переходит в G1-период новой интерфазы.
В телофазе начинается и заканчивается процесс разрушения митотического аппарата — разборка микротрубочек. Он идет от полюсов к экватору бывшей клетки: именно в средней части веретена микротрубочки сохраняются дольше всего (остаточное тельце).
Одно из главных событий телофазы — разделение клеточного тела, т.е. цитотомия, или цитокинез. Выше уже говорилось, что у растений деление клетки происходит путем внутриклеточного образования клеточной перегородки, а у клеток животных — путем перетяжки, впячивания плазматической мембраны внутрь клетки.
Митоз не всегда заканчивается разделением тела клетки. Так, в эндосперме многих растений некоторое время могут идти множественные процессы митотического деления ядер без деления цитоплазмы: образуется гигантский многоядерный симпласт. Так же, без цитотомии, синхронно делятся многочисленные ядра плазмодиев миксомицетов. На ранних этапах развития зародышей некоторых насекомых также осущестляется неоднократное деление ядер без деления цитоплазмы.
В большинстве случаев закладка перетяжки при делении клеток животных происходит строго в экваториальной плоскости веретена. Здесь в конце анафазы, в начале телофазы, возникает кортикальное скопление микрофиламентов, которые образуют сократимое кольцо (см. рис. 258). В состав микрофиламентов кольца входят актиновые фибриллы и короткие палочковидные молекулы из полимеризованного миозина II. Взаимное скольжение этих компонентов приводит к уменьшению диаметра кольца и к появлению вдавления плазматической мембраны, что в конце обусловливает перетяжку исходной клетки надвое.
После цитотомии две новые (дочерние) клетки переходят в стадию G1 , клеточного периода. К этому времени возобновляются цитоплазматические синтезы, происходит реставрация вакуолярной системы, диктиосомы аппарата Гольджи снова концентрируются в околоядерной зоне в ассоциации с центросомой. От центросомы начинается отрастание цитоплазматических микротрубочек и восстановление интерфазного цитоскелета.

Самоорганизация системы микротрубочек
Обзор становления митотического аппарата показывает, что для процесса сборки сложного ансамбля микротрубочек необходимо наличие как центров организации микротрубочек, так и хромосом.
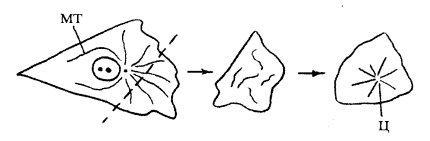
Однако существует ряд примеров, показывающих, что образование цитастеров и веретен может идти независимо, путем самоорганизации. Если с помощью микроманипулятора отрезать часть цитоплазмы фибробласта, в которой не была бы расположена центриоль, то происходит спонтанная реорганизация системы микротрубочек. Вначале в отрезанном фрагменте они располагаются хаотически, но через некоторое время они собираются своими концами в звездоподобную структуру — цитастер, где на периферии клеточного фрагмента находятся плюс-концы микротрубочек (рис. 321). Сходная картина наблюдается у бесцентриолярных фрагментов меланофоров — пигментных клеток, несущих гранулы пигмента меланина. В этом случае происходит не только самосборка цитастера, но и рост микротрубочек от гранул пигмента, собранного в центре клеточного фрагмента.
|
Рис. 321. Спонтанное образование цитастера (Ц) из микротрубочек (МТ) в клеточном фрагменте (цитопласте), лишенном клеточного центра |
В других случаях самосборка микротрубочек может приводить к образованию митотических веретен. Так, в одном из экспериментов был выделен цитозоль из делящихся яиц ксенопуса. Если в такой препарат поместить мелкие шарики, облепленные фаговой ДНК, то возникает митотическая фигура, где место хромосом занимают эти шарики ДНК, не имеющие кинетохорных последовательностей, а к ним примыкают два полуверетена, в полюсах которых нет никаких ЦОМТ.
Сходные картины наблюдаются и в естественных условиях. Например, при делении яйцеклетки дрозофилы при отсутствии центриолей вокруг группы прометафазных хромосом начинают хаотически полимеризоваться микротрубочки, которые затем перестраиваются в биполярное веретено и связываются с кинетохорами. Аналогичная картина отмечается во время мейотического деления яйцеклетки ксенопуса. Здесь также вначале происходит спонтанная организация не ориентированных микротрубочек вокруг группы хромосом, а позже образуется нормальное биполярное веретено, в полюсах которого также отсутствуют центросомы (рис. 322).
|
Рис. 322. Спонтанное образование веретена деления в мейозе ооцита Xenopus (по: Vernos, Karsenti, 1995) 1 — микротрубочки; 2 — хромосомы |
Эти наблюдения привели к выводам, что в самоорганизации микротрубочек принимают участие моторные белки, кинезинопободные и динеиноподобные. Были обнаружены моторные плюс-концевые белки — хромокинезины, которые связывают хромосомы с микротрубочками и заставляют последние двигаться в направлении минус-конца, что приводит к образованию конвергентной структуры типа полюса веретена. С другой стороны, динеинподобные моторы, связанные с вакуолями или гранулами, могут перемещать микротрубочки так, что их минус-концы будут стремиться образовывать конусовидные пучки, будут сходиться в центре полуверетен (рис. 323). Похожие процессы происходят при образовании митотических веретен в растительных клетках.
|
Рис. 323. Схема процесса организации веретена за счет хромокинезинов, связывающих хромосомы и микротрубочки, и засчет динеинов, локализованных на везикулярных частицах 1 — микротрубочки; 2 — хромокинезины; 3 — хромосомы; 4 — динеины на везикулах |

Митоз растительной клетки
Митотическое деление клеток высших растений имеет ряд характерных особенностей, которые касаются начала и конца этого процесса. В интерфазных клетках различных меристем растений микротрубочки располагаются в кортикальном подмембранном слое цитоплазмы, образуя кольцевые пучки микротрубочек (рис. 324). Периферические микротрубочки контактируют с ферментами, образующими фибриллы целлюлозы, с целлюлозосинтетазами, которые являются интегральными белками плазматической мембраны. Они синтезируют целлюлозу на поверхности плазматической мембраны. Считается, что в процессе роста целлюлозной фибриллы эти ферменты передвигаются вдоль подмембранных микротрубочек.
|
Рис. 324. Стадии митоза растительной клетки а — микротрубочки в кортикальном слое цитоплазмы интерфазной растительной клетки; б — препрофазное кольцо микротрубочек; в — профаза, образование веретена; г — метафаза; д — анафаза; е — телофаза, образование фрагмопласта; ж — переход к интерфазе; з — интерфаза |
Митотическая перестройка элементов цитоскелета происходит в начале профазы. При этом исчезают микротрубочки в периферических слоях цитоплазмы, но в примембранном слое цитоплазмы в экваториальной зоне клетки возникает кольцевидный пучок микротрубочек — препрофазное кольцо, в которое входит более 100 микротрубочек (рис. 325). Иммунохимически в этом кольце обнаружен также актин. Важно отметить, что препрофазное кольцо микротрубочек располагается там, где в телофазе будет образовываться клеточная перегородка, разделяющая две новые клетки. Позднее в профазе это кольцо начинает исчезать, и новые микротрубочки появляются по периферии профазного ядра. Их число больше в полярных зонах ядер, они как бы оплетают всю ядерную периферию. При переходе к прометафазе возникает биполярное веретено, микротрубочки которого подходят к так называемым полярным шапочкам, в составе которых наблюдаются лишь мелкие вакуоли и неопределенной морфологии тонкие фибриллы; никаких признаков центриолей в этих полярных зонах не обнаруживается. Так формируется анастральное веретено.
|
Рис. 325. Выявление микротрубочек антителами к тубулину при делении клеток растений (фото Е.А. Смирновой) а — профаза; б — метафаза; в — анафаза; г — телофаза; д — цитокинез, образование фрагмопласта. а, б — клетки корневой меристемы пшеницы; в, г, д — клетки эндосперма гемантуса |
В прометафазе при делении растительных клеток также наблюдается сложный дрейф хромосом, их осцилляция и перемещение такого же типа, какие встречаются в прометафазе клеток животных. События в анафазе схожи с таковыми в астральном митозе. После расхождения хромосом возникают новые ядра, также за счет деконденсации хромосом и образования новой ядерной оболочки.
Процесс же цитотомии растительных клеток резко отличается от деления перетяжкой клеток животного происхождения (рис. 326). В данном случае в конце телофазы также происходит разборка микротрубочек веретена в полярных областях. Но микротрубочки основной части веретена между двумя новыми ядрами остаются, более того, здесь образуются новые микротрубочки. Так создаются пучки микротрубочек, с которыми связаны многочисленные мелкие вакуоли. Эти вакуоли произошли от вакуолей аппарата Гольджи и содержат пектиновые вещества. С помощью микротрубочек многочисленные вакуоли движутся к экваториальной зоне клетки, где сливаются друг с другом и образуют в середине клетки плоскую вакуоль — фрагмопласт, который разрастается к периферии клетки, включая все новые и новые вакуоли (рис. 324, 325 и 327).
|
Рис. 326. Сравнение цитотомии клеток высших растений (а) и животных (б) |
|
Рис. 327. Последовательные стадии (а, б, в) образования фрагмопласта 1 — вакуоли; 2 — микротрубочки; 3 — аппарат Гольджи; 4 — слияние вакуолей; 5 — фрагмомласт; 6 — эндоплазматический ретикулум |
Так создается первичная клеточная стенка. В конце концов, мембраны фрагмопласта сливаются с плазматической мембраной: происходит обособление двух новых клеток, разделенных новообразованной клеточной стенкой. По мере расширения фрагмопласта пучки микротрубочек перемещаются все больше к периферии клетки. Вероятно, что процессу растяжения фрагмопласта, отодвигания на периферию пучков микротрубочек способствуют пучки актиновых филаментов, отходящих от кортикального слоя цитоплазмы в том месте, где было препрофазное кольцо.
После разделения клетки микротрубочки, участвовавшие в транспорте мелких вакуолей, исчезают. Новое поколение интерфазных микротрубочек образуется на периферии ядра, а затем располагается в кортикальном примембранном слое цитоплазмы.
Таково общее описание деления растительных клеток, однако этот процесс изучен крайне недостаточно. В полярных зонах веретен не обнаружены белки, входящие в состав ЦОМТ животных клеток. Было выявлено, что в растительных клетках в этой роли может выступать ядерная оболочка, от которой плюс-концы микротрубочек направлены к периферии клетки, а минус-концы - к ядерной оболочке. При образовании же веретена кинетохорные пучки ориентированы минус-концом к полюсу, а плюс-концом к кинетохорам. Как происходит такая переориентация микротрубочек, остается не выясненным.
При переходе к профазе вокруг ядра появляется плотная сеть микротрубочек, напоминающая корзинку, которая затем по форме начинает напоминать веретено. При этом микротрубочки образуют ряд сходящихся пучков, направленных в сторону полюсов. Позднее в прометафазе происходит связь микротрубочек с кинетохорами. В метафазе кинетохорные фибриллы могут формировать общий центр схождения — миниполюса веретена, или центры конвергенции микротрубочек. Вероятнее всего, образование таких миниполюсов осуществляется за счет объединения минус-концов микротрубочек, связанных с кинетохорами. По-видимому, в клетках высших растений процесс реорганизации цитоскелета, в том числе и образование митотического веретена, связан с самоорганизацией микротрубочек, которая, как и в клетках животных, происходит при участии моторных белков.

Движение и деление бактериальных клеток
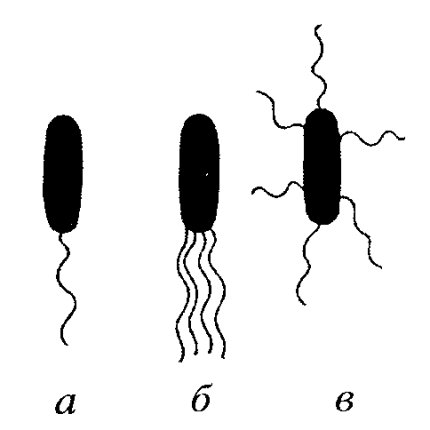
Многие бактерии способны к быстрому движению с помощью своеобразных бактериальных жгутиков, или флагелл. Основная форма движения бактерий — с помощью жгутика. Жгутики бактерий принципиально отличаются от жгутиков эукариотических клеток. По числу жгутиков их делят на: монотрихи — с одним жгутиком, политрихи — с пучком жгутиков, перитрихи — с множеством жгутиков в разных участках поверхности (рис. 328).
|
Рис. 328. Формы жгутиковых бактерий а — монотрих; 6 — лофотрих; в — перитрих |
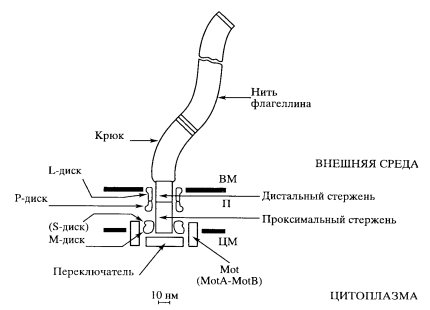
Жгутики бактерий имеют очень сложное строение; они состоят из трех основных частей: внешняя длинная волнистая нить (собственно жгутик), крючок, базальное тельце (рис. 329).
|
Рис. 329. Схема строения бактериального жгутика грамотрицательной бактерии (Jones, Macnub, 1990) ВМ — внешняя мембрана; ЦМ — цитоплазматическая мембрана; П — периплазма |
Жгутиковая нить построена из белка флагеллина. Его молекулярная масса колеблется в зависимости от вида бактерий (40—60 тыс.). Глобулярные субъединицы флагеллина полимеризуются в спирально закрученные нити так, что образуется трубчатая структура (не путать с микротрубочками эукариот!) с диаметром 12-25 нм, полая изнутри. Флагеллины не способны к движению. Они могут спонтанно полимеризоваться в нити с постоянным шагом волны, характерным для каждого вида. В живых бактериальных клетках нарастание жгутиков происходит на их дистальном конце; вероятно, транспорт флагеллинов осуществляется через полую середину жгутика.
Вблизи клеточной поверхности жгутиковая нить, флагелла, переходит к более широкому участку, так называемому крючку. Он имеет длину около 45 нм и состоит из другого белка.
Бактериальное базальное тельце не имеет ничего общего с базальным тельцем эукариотической клетки (см. рис. 290, б, в). Оно состоит из стержня, связанного с крючком, и четырех колец — дисков. Два верхних кольца диска, имеющихся у грамотрицательных бактерий, локализованы в клеточной стенке: одно кольцо (L) погружено в липосахаридную мембрану, а второе (Р) — в муреиновый слой. Два других кольца — белковый комплекс S-статор и М-ротор, локализованы в плазматической мембране. К этому комплексу со стороны плазматической мембраны примыкает кольцевой ряд белков Mot А и В.
В базальных тельцах грамположительных бактерий имеются только два нижних кольца, связанных с плазматической мембраной. Базальные тельца вместе с крючками можно выделить. Оказалось, что они содержат в своем составе около 12 различных белков.
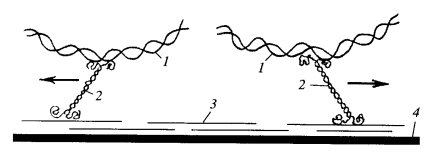
Принцип движения бактериальных жгутиков совершенно иной, чем у эукариот. Если у эукариот жгутики движутся за счет продольного скольжения дуплетов микротрубочек, то у бактерий движение жгутиков происходит за счет вращения базального тельца (а именно S- и М-дисков) вокруг своей оси в плоскости плазматической мембраны.
Это было доказано рядом экспериментов. Так, закрепляя жгутики на подложке с помощью антител к флагеллину, исследователи наблюдали вращение бактерий. Отмечено, что многочисленные мутации по флагеллинам (изменение изгиба нити, «курчавость» и т.д.) не сказываются на способности клеток к движению. Мутации же по белкам базального комплекса часто приводят к потере движения.
Движение бактериальных жгутиков не зависит от АТФ, а осуществляется благодаря трансмембранному градиенту ионов водорода на поверхности плазматической мембраны. При этом происходит вращение М-диска.
В окружении М-диска Mot-белки способны к переносу ионов водорода из периплазматического пространства в цитоплазму (за одни оборот переносится до 1000 ионов водорода). При этом жгутики вращаются с огромной скоростью — 5-100 об/с, что дает возможность бактериальной клетке перемещаться на 25—100 мкм/с.
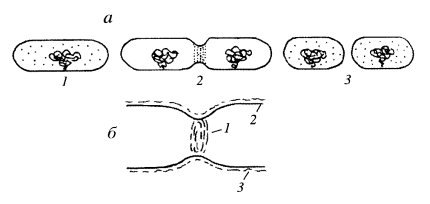
Обычно деление бактериальных клеток описывается как «бинарное»: после удвоения нуклеоиды, связанные с плазматической мембраной, расходятся за счет растяжения мембраны между нуклеоидами, а затем образуется перетяжка, или септа, делящая клетку надвое. Этот тип деления приводит к очень точному распределению генетического материала, практически без ошибок (менее 0,03% дефектных клеток). Напомним, что ядерный аппарат бактерий, нуклеоид, представляет собой циклическую гигантскую (1,6 мм) молекулу ДНК, образующую многочисленные петлевые домены в состоянии сверхспирализации, порядок укладки петлевых доменов неизвестен.
Среднее время между делениями бактериальных клеток составляет 20—30 мин. В этот период должен произойти целый ряд событий: репликация ДНК нуклеоида, сегрегация, отделение сестринских нуклеоидов, их дальнейшее расхождение, цитотомия за счет образования септы, делящей исходную клетку ровно пополам.
Все эти процессы в последние годы интенсивно исследовались, в результате были получены важные и неожиданные наблюдения. Так, оказалось, что в начале синтеза ДНК, который начинается с точки репликации (origin), обе растущие молекулы ДНК изначально остаются связанными с плазматической мембраной (рис. 330). Одновременно с синтезом ДНК происходит процесс снятия сверхспирализации как старых, так и реплицирующихся петлевых доменов за счет целого ряда ферментов (топоизомеразы, гиразы, лигазы и др.), что приводит к физическому обособлению двух дочерних (или сестринских) хромосом нуклеоидов, которые еще находятся в тесном контакте друг с другом. После такой сегрегации нуклеоиды расходятся от центра клетки, от места их бывшего расположения. Причем это расхождение очень точное: на четверть длины клетки в двух противоположных направлениях. В результате этого в клетке располагаются два новых нуклеоида. Каков механизм этого расхождения? Делались предположения (Деламатер, 1953), что деление бактериальных клеток аналогично митозу эукариот, однако данных в пользу этого предположения долгое время не появлялось.
|
Рис. 330. Удвоение бактериальной хромосомы (нуклеоида) (1) Точка начала репликации (2) остается связанной с плазматической мембраной (3). 1' — сестринские реплипиронанные хромосомы |
Новые сведения о механизмах деления бактериальных клеток были получены при изучении мутантов, в которых происходили нарушения клеточного деления.
Было обнаружено, что в процессе расхождения нуклеоидов принимают участие несколько групп специальных белков. Один из них — белок Muk В, представляет собой гигантский гомодимер (мол. масса около 180 кДа, длина 60 нм), состоящий из центрального спирального участка и концевых глобулярных участков, напоминающий по структуре нитевидные белки эукариот (цепь миозина II, кинезина). На N-конце Muk В связывается с ГТФ и АТФ, а на С-конце — с молекулой ДНК. Эти свойства Muk В дают основания считать его моторным белком, участвующим в расхождении нуклеоидов. Мутации этого белка приводят к нарушениям расхождения нуклеоидов: в мутантной популяции появляется большое количество безъядерных клеток.
Кроме белка Muk В в расхождении нуклеоидов, по-видимому, участвуют пучки фибрилл, содержащих белок Caf А, который может связываться с тяжелыми цепями миозина, подобно актину (рис. 331).
|
Рис. 331. Расхождение бактериальных хромосом 1 — ДНК реплицированных нуклеоидов; 2 — моторный белок Muk В; 3 — фибриллярный белок Caf А; 4 — плазматическая мембрана. Стрелки показывают направления расхождения бактериальных хромосом |
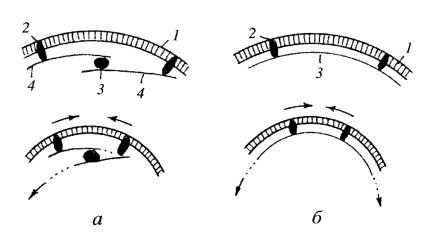
Образование перетяжки, или септы, также в общих чертах напоминает цитотомию животных клеток. В данном случае в создании септ принимают участие белки семейства Fts (фибриллярные термочувствительные). В эту группу входят несколько белков, среди которых наиболее изучен белок FtsZ. Он сходен у большинства бактерий, архибактерий, его обнаруживают в микоплазмах и хлоропластах. Это глобулярный белок, схожий по своей аминокислотной последовательности с тубулином. При взаимодействии с ГТФ in vitro он способен образовывать длинные нитчатые протофиламенты. В интерфазе FtsZ диффузно локализуется в цитоплазме, его количество очень велико (5—20 тыс. мономеров на клетку). Во время деления клетки весь этот белок локализуется в зоне септы, образуя сократимое кольцо, очень напоминающее актомиозиновое кольцо при делении клеток животного происхождения (рис. 332). Мутации по этому белку приводят к прекращению деления клеток: возникают длинные клетки, содержащие множество нуклеоидов. Эти наблюдения показывают прямую зависимость деления бактериальных клеток от наличия Fts-белков.
|
Рис. 332. Участие белка Fts-Z в образовании клеточной перетяжки при делении бактерии а — в интерфазе белок Fts-Z диффузно распределен в цитоплазме (1), при делении он концентрируется и области перетяжки (2), 3 — разделившаяся бактериальная клетка; б — в зоне перетяжки белок Fts-Z образует сократимое кольцо (1), 2 — плазматическая мембрана, 3 — клеточная стенка |
Относительно механизма образования септ существует несколько гипотез, постулирующих сокращение кольца в зоне септы, приводящее к разделению исходной клетки надвое. По одной из них протофиламенты должны скользить один относительно другого с помощью неизвестных еще моторных белков, по другой — сокращение диаметра септы может происходить за счет деполимеризации заякоренных на плазматической мембране FtsZ (рис. 333).
|
Рис. 333. Гипотезы механизма сокращения кольца при делении бактерий а — за счет работы гипотетического моторного белка (3) молекулы белка Fts-Z (4) сближаются и деполимеризуются: 1 — плазматическая мембрана, 2 — интегральные белки, связывающие Fts-Z; б — деполимеризация белка Fts-Z (3) сопровождается сближением интегральных белков (2) плазматической мембраны |
Параллельно образованию септы идет наращивание муреиноного слоя бактериальной клеточной стенки за счет работы полиферментативного комплекса РВР-3, синтезирующего пептидогликаны.
Таким образом, при делении бактериальных клеток осуществляются процессы, во многом сходные с делением эукариот: расхождение хромосом (нуклеоидов) за счет взаимодействия моторных и фибриллярных белков, образование перетяжки за счет фибриллярных белков, создающих сократимое кольцо. У бактерий в отличие от эукариот в этих процессах принимают участие совсем иные белки, но принципы организации отдельных этапов клеточного деления очень сходны.

Величко В.В. © Copyright 2008.![]()
![]()