О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыОБЩИЕ СВОЙСТВА БИОЛОГИЧЕСКИХ МЕМБРАН - ЛИПОПРОТЕИДНЫХ КОМПЛЕКСОВ
ВАКУОЛЯРНАЯ СИСТЕМА ВНУТРИКЛЕТОЧНОГО ТРАНСПОРТА
ГЛАДКИЙ РЕТИКУЛУМ И ДРУГИЕ МЕМБРАННЫЕ ВАКУОЛИ

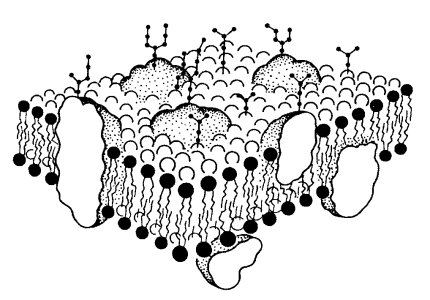
Все без исключения клеточные мембраны построены по общему принципу: это тонкие липопротеидные пленки, состоящие из двойного слоя липидных молекул, в который включены молекулы белка. В весовом отношении в зависимости от типа мембран на долю липидов приходится 25-60%, на долю белков — 40-75%. В состав многих мембран входят углеводы, количество которых может достигать 2-10%.

Двойной слой липидов - структурная основа мембран
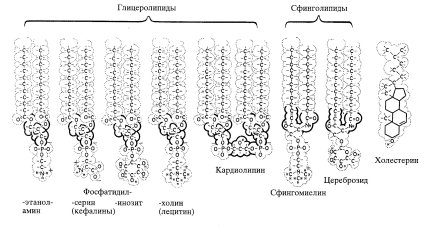
К липидам относится большая группа органических веществ, обладающих плохой растворимостью в воде (гидрофобность) и хорошей растворимостью в органических растворителях (липофильность). Состав липидов, входящих в мембраны клетки, очень разнообразен (рис. 116). Характерными представителями липидов, встречающихся в клеточных мембранах, являются фосфолипиды (глицерофосфатиды), сфингомиелины и из стероидных липидов — холестерин.
|
Рис. 116. Структурные формулы некоторых важнейших липидов |
Глицерофосфатиды, или глицеролипиды, представляют собой сложные эфиры трехатомного спирта глицерина с двумя жирными кислотами и с фосфорной кислотой, которая в свою очередь может быть связана с различными химическими группами (холин, серии, инозит, этаноламин и др.). Например, в структуру наиболее часто встречающегося в мембранах глицеролипида лецитина входят участки двух жирных кислот, глицерина, фосфорной кислоты и холина. Другая группа мембранных липидов называется сфингомиелиновой, в ней глицерин замещен аминоспиртом сфингозином.
Из липидов, относящихся к стероидам, в мембранах больше всего холестерина. В растительных клетках холестерин не обнаружен, его там заменяют фитостерины. У бактерий стерины отсутствуют.
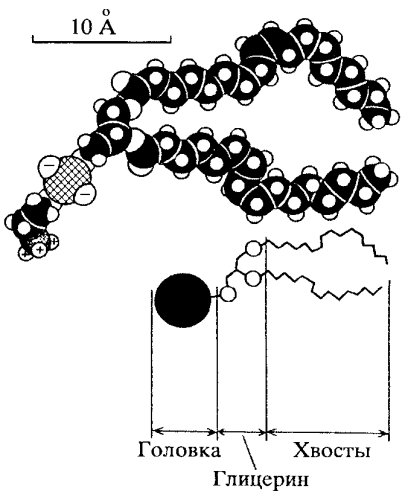
Характерной особенностью липидов мембран является разделение их молекулы на две функционально различные части: неполярные (не несущие зарядов) хвосты, состоящие из жирных кислот, и заряженные полярные головки (рис. 117). Полярные головки несут на себе отрицательные заряды или могут быть нейтральными (в случае, если они имеют одновременно положительные и отрицательные заряды). Наличие неполярных хвостов липидов объясняет их хорошую растворимость в жирах и органических растворителях.
|
Рис. 117. Схема строения молекул фосфолипидов |
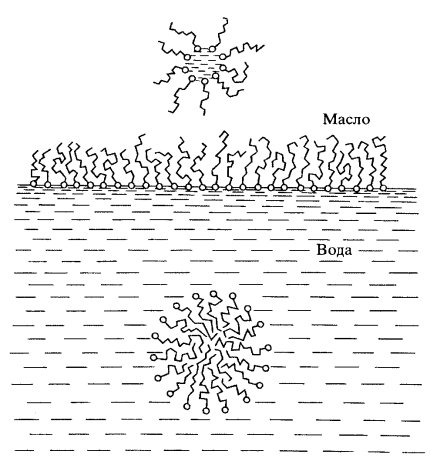
Если полярные липиды смешать с водой, то образуется эмульсия, состоящая из мицелл. При этом незаряженные (гидрофобные) хвосты будут стремиться образовывать однородную фазу в центре мицеллы, а заряженные (гидрофильные) головки будут торчать в водную фазу. Холестерин сам по себе мицелл не образует, но легко включается в мицеллы полярных липидов, в результате чего образуются мицеллы смешанного типа. Если к липидам добавить масло, то образуются мицеллы, как бы вывернутые наизнанку: их гидрофобные хвосты будут обращены в масляную фазу, а заряженные (гидрофильные) головки будут располагаться внутри мицеллы (рис. 118).
|
Рис. 118. Мономолекулярный слой липидов на поверхности раздела фаз вода—масло и мицеллы липидов в масле и воде |
На поверхности воды растворы полярных липидов, растекаясь, образуют мономолекулярную пленку, в которой в водную фазу будут направлены заряженные (гидрофильные) головки, а неполярные хвосты будут обращены в сравнительно гидрофобную воздушную фазу. Смешивая с водой экстрагированные из мембран липиды или беря смеси разных липидов, можно получить бимолекулярные слои или мембраны толщиной около 7,5 нм, где периферические зоны слоя, смотрящие в водную фазу, будут содержать исключительно полярные головки, а незаряженные хвосты будут образовывать общую гидрофобную центральную зону такой образовавшейся мембраны (рис. 119).
|
Рис. 119. Сплошной билипидный слой, образующийся в воде при высокой концентрации липидов |
Эта способность липидов самопроизвольно образовывать мембранные структуры определяется свойствами самих липидов, а именно наличием в их структуре полярных головок и неполярных хвостов.
В таких искусственных системах липидные мицеллы и мембраны могут взаимодействовать с белками своими полярными зонами или гидрофобными хвостами, при этом образуются искусственные липопротеидные мембраны, сходные с теми мембранами, которые можно выделить из клеток. Они имеют толщину около 7,5 нм. При окраске четырехокисью осмия в электронном микроскопе видна трехслойная структура искусственных мембран: два темных периферических слоя толщиной 2,5 нм и светлый, центральный, примерно такой же толщины. Естественные клеточные мембраны имеют такое же строение.
Необходимо подчеркнуть, что как искусственные, так и естественные мембраны не представляют собой плоские слои, они всегда замкнуты сами на себя, образуя полые вакуоли, пузырьки, везикулы, плоские замкнутые мешки или трубчатые образования.
Представление о том, что в основе клеточных мембран лежит двойной липидный слой, было сформулировано еще в 1920-х годах. Если экстрагировать липиды из оболочки эритроцитов, а затем поместить липиды на поверхность водного мениска, то можно рассчитать площадь, занимаемую образовавшимся монослоем липидов. Оказалось, что эта площадь вдвое больше площади, занимаемой поверхностью эритроцитов, из которых были экстрагированы липиды. Было сделано предположение, что в мембранах эритроцитов липиды располагаются в два слоя. К тому же оказалось, что поверхностное натяжение мембраны клетки (1-2 дин/см2) значительно ниже, чем поверхностное натяжение искусственного липидного слоя (7—15 дин/см2). Обнаружено, что при добавлении белка к липидам поверхностное натяжение снижается до величины, характерной для поверхностного натяжения клеток.
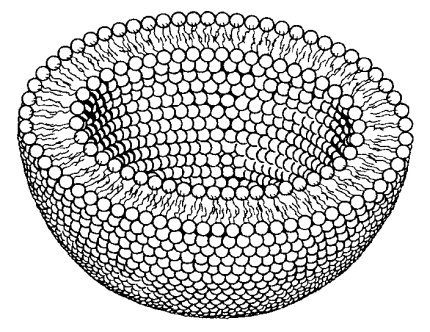
Образовавшиеся искусственные липидные мембраны служат непроницаемым барьером для любых заряженных молекул, даже для ионов солей. Это определяет основное функциональное свойство мембран — служить преградой для свободной диффузии через слой липидов. Такое свойство может быть использовано для практических целей. Например, при смешивании липидов в водной среде образуется масса полых мембранных пузырьков — липосом (рис. 120). Жидкость, попавшая внутрь этих пузырьков, уже не может свободно обмениваться с жидкостью, находящейся снаружи. Таким способом искусственные мембраны липосом можно «загрузить» лекарственными веществами, которые могут в нужных концентрациях поступать к клеткам.
|
Рис. 120. Липосома: замкнутый билипидный слой в виде вакуоли |

Мембранные белки - обязательные компоненты биологических мембран
В среднем в липопротеидных мембранах белки по массе составляют 50%. Но количество белков в разных мембранах может быть различным. Так, в мембранах митохондрий на долю белков приходится около 75%, а в плазматической мембране клеток миелиновой оболочки — около 25%. Но так как липидные молекулы имеют небольшой размер (около 0,5 нм) и невысокую молекулярную массу, их число в 50 раз выше числа белковых молекул. Поэтому белковые молекулы как бы вкраплены в билипидный слой мембраны. Часть из них связана с липидными головками с помощью ионных (солевых) связей и поэтому легко экстрагируется из мембран растворами солей. Другие образуют солевые связи с полярными участками липидов через взаимодействие с ионами Mg2+ или Са2+. Данные белки экстрагируются с помощью хелатных соединений, таких как версен (ЭДТА). Эти легко экстрагируемые белки большей частью расположены на мембранах со стороны цитоплазмы и в цитоплазматической мембране тесно связаны с белковыми структурами цитоскелета.
Большая часть белков взаимодействует с липидами в составе мембран на основе гидрофобных сиязей. Оказалось, что многие мембранные белки состоят как бы из двух частей: из участков, богатых полярными (несущими заряд) аминокислотами, и участков, обогащенных неполярными аминокислотами (глицином, аланином, валином, лейцином). Эти белки в липидных слоях мембран располагаются так, что их неполярные участки как бы погружены в «жирную» часть мембраны, где находятся гидрофобные участки липидов (рис. 121). Полярная (гидрофильная) часть таких белков взаимодействует с головками липидов и обращена в сторону водной фазы (рис. 122), поэтому эти белки, связанные с липидами путем гидрофобных взаимодействий, практически не экстрагируются в водных фазах. Их можно выделить, лишь разрушая мембрану, экстрагируя из нее липиды или органическими растворителями, или детергентами. Поэтому эти белки мембран и называют интегральными.
|
Рис. 121 . Мозаичная модель («липидное озеро») клеточных мембран |
|
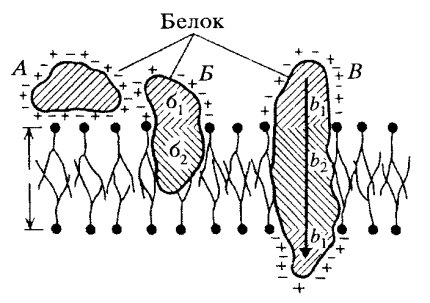
Рис. 122. Взаимодействие белков с липидными слоями А — ионные связи; Б, В — гилрофилыю-гидрофобные взаимодействия белков с билипидным слоем |
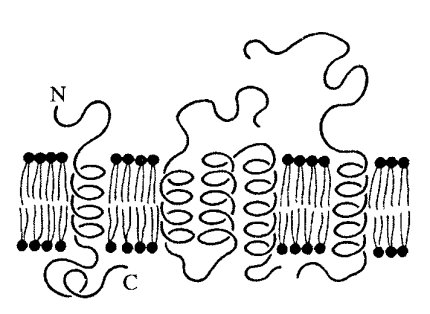
Размер интегральных мембранных белков в среднем равен 8 нм, но встречаются крупные белки — до 35 нм величиной (белок тилакоидов хлоропластов). Обычно это очень асимметричные по своей природе белки и соответственно асимметрично локализованы в мембране (рис. 123): их разные функциональные части локализованы по обе стороны мембраны, и все белки данного типа расположены одинаково. С цитоплазматической стороны мембраны интегральные белки связаны с периферическими белками.
|
Рис. 123. Асимметричное расположение молекул белков в мембранах, определяемое расположением С- и N-концевых и α-спиральных участков полипептидных цепей |

Латеральная подвижность липидов и белков мембран
Исследование искусственных липидных бислоев показало, что эти мембраны представляют собой двумерную жидкость, обладающую вязкостью, сравнимую с вязкостью оливкового масла. В составе таких и естественных мембран молекулы липидов постоянно движутся с огромной скоростью (коэффициент диффузии для них равен 10-8 см2·с-1), достигающей 2 мкм/с.
Липидные молекулы двигаются вдоль липидного слоя, могут вращаться вокруг своей оси, а также переходить из слоя в слой, что происходит редко и с помощью специальных переносчиков. Белки, плавающие в «липидном озере», также обладают латеральной, продольной подвижностью, но скорость их перемещения в десятки и сотни раз ниже. Изучать перемещение белковых молекул в составе мембран на живых клетках проще на примере плазматической мембраны. Белки плазматической мембраны - гликопротеины, часто имеют олигосахаридные цепочки, смотрящие на внеклеточную среду.
Для исследования свойств плазматической мембраны широко используются лектины — белки растительного происхождения, которые специфически связываются с олигосахаридами мембранных белков. Так, лектин конканавалин А (КонА), выделенный из растения канавалии мечевидной, связывается с олигосахаридами, имеющими на концах глюкозу или маннозу. Лектин из бобов сои связывается с N-ацетилглюкозамином, а лектин из проростков пшеницы, кроме того, и с галактозой. На поверхности белков-лектинов имеются два или более района специфического связывания с углеводами. Если лектины добавлять к взвеси эритроцитов, то это вызывает их осаждение, сопровождающееся слипанием - агглютинацией. Поэтому лектины еще называют агглютининами.
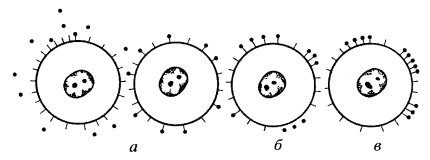
Такая реакция агглютинации эритроцитов вызвана тем, что лектин, например КонА, взаимодействуя с концевыми сахарами углеводов гликопротеидов, как бы сшивает эритроциты друг с другом, чем и вызывает их осаждение. Так как полисахариды есть на поверхности плазматической мембраны любых клеток, то лектины могут связываться с ними. Места посадки лектинов можно увидеть с помощью электронного микроскопа, если связать лектины с электронно-плотным белком ферритином. Более удобно регистрировать лектины на поверхности клеток с помощью иммунофлуоресцентного метода. Использование этого метода позволило исследовать расположение белков в плоскости мембран. Так, оказалось, что при добавлении к клеткам, поверхность которых связана с КонА, антител против КонА, меченных флуорохромом, обнаруживается свечение по всей поверхности клетки. Это значит, что белки-гликопротеиды, полисахаридные цепи которых образуют слой, равномерно разбросаны по поверхности клеток. Однако через некоторое время на поверхности клетки видно не сплошное свечение, а отдельные множественные пятна или точки (их назвали «заплатками» от английского patch). Затем эти пятна собираются в одну зону - «колпачок». Следовательно, белки, связанные с лектинами, могут быстро перемещаться в плоскости плазматической мембраны. Интересно, что «колпачок» всегда формируется над тем местом клетки, где находятся центриоли и аппарат Гольджи. Дальнейшая судьба этого «колпачка» может быть у разных клеток различной: у фибробластов «колпачки» могут отделяться и отрываться от тела при движении клетки, у других (лимфоциты) происходит поглощение этих участков внутрь клетки (эндоцитоз) и переваривание их там (рис. 124).
|
Рис. 124. Перемещение вдоль плазматической мембраны связанных лектинов а — первичная посадка; б — объединение в мелкие сгустки; в — образование «колпачков» |
Латеральную подвижность белковых (гликопротеидных) молекул плазматической мембраны можно наблюдать при изучении клеточных гибридов, имеющих разные поверхностные антигены, которые можно пометить. В этом случае в гибридной клетке антигены поверхностей сначала были разобщены, а через некоторое время они равномерно распределились по всей поверхности гетерокариона.

Асимметричность клеточных мембран
Состав липидов по обе стороны мембраны различен, что определяет асимметричность в строении билипидного слоя. Так, с помощью химического маркирования было найдено, что 80% сфингомиелина, 75% фосфатидилхолина и 20% фосфатидилэтаноламина локализованы на наружной поверхности плазматической мембраны, на внутренней — располагается весь фосфатидилсерин и 80% фосфатидилэтаноламина. Примерно такую же композицию имеют мембраны эндоплазматического ретикулума (для них наружной надо считать ту поверхность, которая обращена внутрь полости).
Особенно выражена асимметрия мембран в отношении интегральных белков. В составе естественных мембран белки строго ориентированы. Большей частью их N-концы смотрят в полость вакуолей или в случае плазматической мембраны — во внешнюю для клетки среду. Такое полярное расположение цепи белковой молекулы в липидном бислое создается в процессе синтеза мембранного белка на рибосоме. Полуинтегральные и примембранные белки также асимметрично расположены в мембранах. Так, в эндоплазматическом ретикулуме белки- ферменты, синтезирующие липиды, расположены на цитозольной стороне мембран, а ферменты, пришивающие сахара к белковым цепочкам (гликозидазы), локализованы на внешней стороне мембраны.
Наличие углеводного компонента характерно практически для всех мембран клетки, но особенно для мембран вакуолярной системы и плазматической мембраны. Углеводный компонент мембран представлен главным образом гликопротеинами — молекулами белков, ковалентно (в отличие от нуклеопротеидов) связанных с цепочками углеводов. Как правило, цепочки углеводов расположены в наружных слоях мембран (для цитоплазматических вакуолей наружными считают слои, обращенные не к матриксу цитоплазмы, а в полость везикул или вакуолей). Они имеют ковалентные связи с интегральными белками, образуя гликопротеиды, или с липидами (гликолипиды). Углеводы мембран представляют собой короткие линейные или разветвленные цепочки, в состав которых входят галактоза, манноза, фруктоза, сахароза, N-ацетилглюкозамин, N-ацетилгалактозамин, пентозы (арабиноза и ксилоза), а также нейраминовая (сиаловая) кислота. Значение этого компонента очень велико для функционирования плазматической мембраны.

Различные свойства разных мембран
Несмотря на поразительную схожесть строения различных мембран, построенных по принципу липидного бислоя с вмонтированными в него белками, физические и химические свойства разных мембран различны. Это связано с тем, что в разных мембранах общий состав липидов значительно различается, что определяет особые свойства мембран.
Разные мембраны клетки могут отличаться друг от друга по количеству липидов. Так, плазматическая мембрана содержит 35-40%, а мембраны митохондрий — 27-29% липидов. Самое высокое содержание липидов в плазматической мембране шванновских клеток, образующих миелиновую оболочку нервов, — до 80%.
Обнаружено, что клеточные мембраны сильно отличаются друг от друга по составу липидов. Так, плазматические мембраны клеток животных богаты холестерином (до 30%) и в них мало лецитина, в то вре мя как мембраны митохондрий, наоборот, богаты фосфолипидами и бедны холестерином. Из общего количества липидов содержание фосфатидилхолина (лецитина) во фракциях эндоплазматической сети составляет 60—70% от всех фосфолипидов, в то время как в плазматической мембране его может быть 25-35%.
В целом для плазматической мембраны характерно высокое содержание холестерина и сфинголипидов, а также преобладание насыщенных и мононенасыщенных жирных кислот в составе фосфолипидов, тогда как в митохондриях, эндоплазматической сети и во многих других цитоплазматических мембранах содержится мало холестерина и сфинголипидов и сравнительно много полиненасыщенных жирных кислот. Видимо, в связи с этим мембраны цитоплазмы менее жесткие, чем плазматическая мембрана, они более «легкоплавки».
Особенно отличаются мембраны по составу белков, которые главным образом определяют функциональные свойства мембран.
По биологической роли мембранные белки можно разделить на три группы: ферменты, рецепторные белки и структурные белки. Набор ферментов в составе мембран может быть очень велик и разнообразен (например, в плазматической мембране клеток печени обнаружено не менее 24 различных ферментов). В разных мембранах существует характерный набор ферментов. Например, в плазматической мембране, как и во многих других, локализуется (К+/Na+)-зависимая АТФаза, участвующая в транспорте ионов. В митохондриях специфическими являются набор белков-переносчиков электронов и фермент АТФ-синтетаза, обеспечивающие окислительное фосфорилирование и синтез АТФ.
Рецепторные белки специфически связываются с теми или иными веществами и как бы их узнают. Это белки-рецепторы для гормонов, для узнавания поверхности соседних клеток, вирусов, фагов у бактерий и т.д. К этой группе относятся фоторецепторные белки. Вообще же рецепторные белки входят в состав любых мембран. Так, на внешней мембране митохондрий расположены рецепторы, участвующие в узнавании и транспорте митохондриальных белков, переносимых из цитозоля в митохондрии. На мембранах эндоплазматического ретикулума находятся рецепторы, узнающие и связывающие рибосомы, на ядерной оболочке - рецепторы кариофильных белков и т.д. На плазматической мембране расположены как рецепторы, узнающие соседние клетки или даже отдельные ионы солей (переносчики), так и белки, узнающие белки цитоскелета в цитоплазме.

Связь мембран с цитоплазматическими белками
Со стороны цитоплазмы мембраны связаны через примембранные или собственно мембранные интегральные белки с разнообразными белковыми структурами цитоплазмы. К ним относятся в первую очередь компоненты цитоскелета. Это позволяет не только сделать мембраны более жесткими, но и обеспечивает подвижность мембран, создавая возможности для их транспортных функций. Например, жесткость плазматической мембраны безъядерных эритроцитов создается за счет связывания сети цитоплазматических белков с интегральными белками плазмалеммы. В ее состав входит белок (так называемый «белок полосы III»), который обеспечивает транспорт ионов через бислой, но одновременно через ряд белков связывается с сетью белков-спектринов, которые создают жесткую подмембранную сеть (рис. 125). Во многих эпителиальных клетках специальные белки плазматической мембраны связываются с элементами цитоскелета и участвуют в образовании целого ряда межклеточных соединений (десмосомы, адгезивный контакт и др.). С элементами цитоскелета связаны также оболочки клеточного ядра: внешняя ядерная мембрана тесно ассоциирована с промежуточными филаментами, которые фиксируют ядро в объеме цитоплазмы. Внутриклеточные вакуоли могут перемещаться в клетке только при взаимодействии с фибриллярными компонентами, такими как микротрубочки и микрофиламенты. Митохондрии перемещаются в клетке также за счет ассоциации с элементами цитоскелета.
|
Рис. 125. Примембранные белки эритроцитов 1 — спектрин; 2 — актин; 3 — анкирин; 4 — белок III полосы; 5 — плазмалемма |

Рост многих мембран за счет встраивания вакуолей
После деления клеток происходит увеличение объемов растущих дочерних клеток и тем самым рост клеточной поверхности, увеличение площади плазматической мембраны. Но это не единственный пример быстрого роста объема и поверхности. Поверхность быстро растущих клеток в тычиночных нитях злаков может за 1 ч увеличиться в 65 раз, т.е. каждую минуту плазмалемма нарастает на ее первоначальную величину. Такую большую скорость роста плазматической мембраны можно объяснить только тем, что происходит быстрое встраивание (интеркаляция) пузырьков в растущую плазматическую мембрану. Здесь внутриклеточные мембранные пузырьки подходят к внутренней стороне плазматической мембраны (возможно, их подгоняют к себе микрофиламенты кортикального слоя), происходит слияние мембран и тем самым увеличение поверхности плазматической мембраны (рис. 126).
|
Рис. 126. Слияние клеточных мембран с мембранными вакуолями |
Откуда же берутся эти готовые блоки, мембранные пузырьки? Удалось проследить, что первичный генезис мембран происходит в гранулярном эндоплазматическом ретикулуме, который является источником всех клеточных мембран, кроме мембран митохондрий и пластид. От мембран гранулярного ЭПР отщепляются мелкие вакуоли, которые сливаются с мембранами аппарата Гольджи, от которого в свою очередь отщепляются мелкие мембранные вакуоли, сливающиеся или с лизосомами, или с плазматической мембраной, или с секреторными вакуолями.
Таким образом, наблюдается последовательный каскад переходов одних мембран в другие. Первичные же мембранные вакуоли строятся за счет синтеза белка и липидов на мембранах гранулярного ЭПР.
Рост мембран митохондрий и пластид иного характера. Увеличение площади мембран митохондрий происходит за счет синтеза основной массы белков и липидов в гиалоплазме клетки, вслед за чем эти митохондриальные белки и липиды транспортируются через мембранную оболочку митохондрий и встраиваются в их компоненты.

Величко В.В. © Copyright 2008.![]()
![]()