О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыОБЩИЕ СВОЙСТВА БИОЛОГИЧЕСКИХ МЕМБРАН - ЛИПОПРОТЕИДНЫХ КОМПЛЕКСОВ
ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА
ВАКУОЛЯРНАЯ СИСТЕМА ВНУТРИКЛЕТОЧНОГО ТРАНСПОРТА
ГЛАДКИЙ РЕТИКУЛУМ И ДРУГИЕ МЕМБРАННЫЕ ВАКУОЛИ

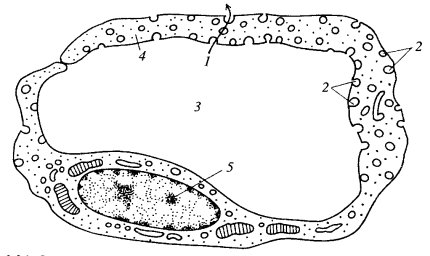
Плазматическая мембрана, или плазмалемма, среди различных клеточных мембран занимает особое место. Это поверхностная периферическая структура, ограничивающая клетку снаружи, что обусловливает ее непосредственную связь с внеклеточной средой, а следовательно, со всеми веществами и стимулами, воздействующими на клетку.
Поэтому плазматическая мембрана играет роль барьера, преграды между сложно организованным внутриклеточным содержимым и внешней средой. В этом случае плазмалемма выполняет не только роль механического барьера, но, главное, ограничивает свободный поток низко- и высокомолекулярных веществ в обе стороны через мембрану. Более того, плазмалемма выступает как структура, «узнающая», рецептирующая, различные химические вещества и регулирующая избирательно транспорт этих веществ в клетку и из нее. Другими словами, плазматическая мембрана осуществляет функции, связанные с регулируемым избирательным трансмембранным транспортом веществ, и исполняет роль первичного клеточного анализатора. В этом отношении плазмалемму можно считать клеточным органоидом, входящим в вакуолярную систему клетки. Как и другие мембраны этой системы (мембраны лизосом, эндосом, аппарата Гольджи и др.), она возникает и обновляется за счет синтетической активности эндоплазматического ретикулума и имеет сходную композицию. Как ни странно, но плазматическую мембрану можно уподобить мембране внутриклеточной вакуоли, но вывернутой наизнанку: она не окружена гиалоплазмой, а окружает ее.

Барьерно-транспортная роль плазмалеммы
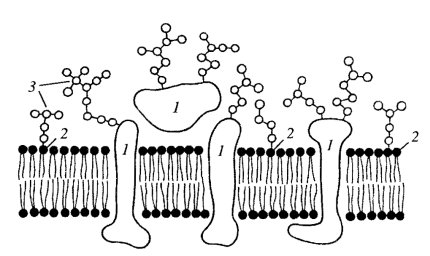
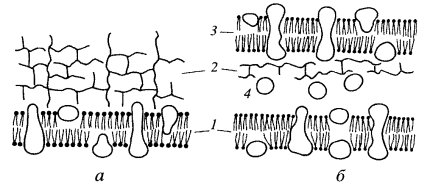
Окружая клетку со всех сторон, плазматическая мембрана выполняет роль механического барьера. Для того чтобы проколоть ее с помощью микроигл или микропипеток, требуется довольно большое усилие. При давлении на нее микроиглы она сначала сильно прогибается, а лишь затем прорывается. Искусственные липидные мембраны менее устойчивы. Эта механическая устойчивость плазматической мембраны может определяться дополнительными компонентами, такими как гликокаликс и кортикальный слой цитоплазмы (рис. 127).
|
Рис. 127. Схема строения плазматической мембраны Часть белков (гликопротеиды) (1) и липидов (гликолипиды) (2) связана с полисахаридами (3), образуя слой гликокаликса |
Гликокаликс представляет собой внешний по отношению к липопротеидной мембране слой, содержащий полисахаридные цепочки мембранных интегральных белков — гликопротеидов. Эти цепочки содержат такие углеводы, как манноза, глюкоза, N-ацетилглюкозамин, сиаловая кислота и др. Такие углеводные гетерополимеры образуют ветвящиеся цепочки, между которыми могут располагаться выделенные из клетки гликолипиды и протеогликаны. Слой гликокаликса сильно обводнен, имеет желеподобную консистенцию, что значительно снижает в этой зоне скорость диффузии различных веществ. Здесь же могут «застревать» выделенные клеткой гидролитические ферменты, участвующие во внеклеточном расщеплении полимеров (внеклеточное пищеварение) до мономерных молекул, которые затем транспортируются в цитоплазму через плазматическую мембрану.
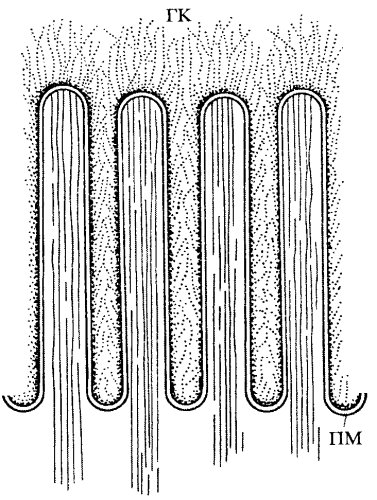
Как показали электронно-микроскопические исследования, особенно с применением специальных методов контрастирования полисахаридов, гликокаликс имеет вид рыхлого волокнистого слоя толщиной 3—4 нм, покрывающего всю поверхность клетки. Особенно хорошо гликокаликс выражен в щеточной каемке клеток всасывающего эпителия кишечника (энтероциты), однако он обнаружен практически у всех животных клеток, но степень его выраженности различна (рис. 128).
|
Рис. 128. Слой гликокаликса (ГК) на поверхности плазматической мембраны (ПМ) микроворсинок щеточной каемки энтероцита |
Механическая устойчивость плазматической мембраны, кроме того, обеспечивается структурой примыкающего к ней со стороны цитоплазмы кортикального слоя и внутриклеточных фибриллярных структур.
Кортикальный (от слова cortex - кора, кожица) слой цитоплазмы, тесно контактирующий с липопротеидной наружной мембраной, имеет ряд особенностей. Здесь в толщине 0,1-0,5 мкм отсутствуют рибосомы и мембранные пузырьки, но в большом количестве встречаются фибриллярные элементы цитоплазмы — микрофиламенты и часто микротрубочки. Основным фибриллярным компонентом кортикального слоя является сеть актиновых микрофибрилл. Здесь же располагается ряд вспомогательных белков, необходимых для движения участков цитоплазмы (подробнее о скелетно-двигательной системе клеток см. здесь). Роль этих связанных с актином белков очень важна, так как она объясняет их участие в связи, в «заякоривании» интегральных белков плазматической мембраны.
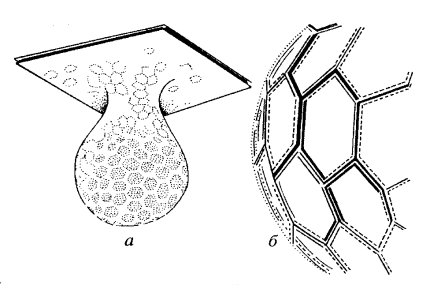
У многих простейших, особенно у инфузорий, плазматическая мембрана принимает участие в образовании пелликулы — жесткого слоя, часто определяющего форму клетки. К плазматической мембране здесь изнутри могут примыкать мембранные мешочки; в этом случае у поверхности клеток имеются три мембранных слоя: собственно плазматическая мембрана и две мембраны пелликулярных альвеол. У инфузории туфельки пелликула образует утолщения, располагающиеся в виде шестиугольников, в центре которых находятся реснички (рис. 129). Жесткость пелликулярных образований может быть связана также с элементами цитоплазмы, подстилающими плазматическую мембрану, с кортикальным слоем. Так, в гребнях пелликулы эвглены вблизи мембраны обнаруживаются кроме мембранных вакуолей параллельные пучки микротрубочек и микрофиламентов. Такая фибриллярная периферическая арматура вместе со складчатой многослойной мембранной периферией создает жесткую структуру пелликулы.
|
Рис. 129. Кортикальный слой (пеликула) парамеции 1 — плазматическая мембрана; 2 — ресничка; 3 — альвеолы; 4 — внутренняя мембрана альвеолы; 5 — внешняя мембрана альвеолы |
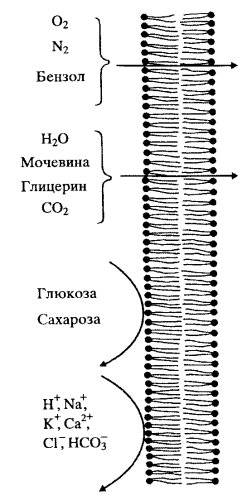
Барьерная роль плазмалеммы заключается также в ограничении свободной диффузии веществ. Модельные опыты на искусственных липидных мембранах показали, что они проницаемы для воды, газов, малых неполярных молекул жирорастворимых веществ, но совершенно не проницаемы для заряженных молекул (ионы) и для крупных незаряженных (сахара) (рис. 130).
|
Рис. 130. Проницаемость искусственного билипидного слоя для различных молекул |
Естественные мембраны также ограничивают скорость проникновения низкомолекулярных соединений в клетку.

Трансмембранный перенос ионов и низкомолекулярных соединений
Плазматическая мембрана, так же как и другие липопротеидные мембраны клетки, является полупроницаемой. Это значит, что через нее с различной скоростью проходят разные молекулы и чем больше размер молекул, тем меньше скорость прохождения их через мембрану. Это свойство определяет плазматическую мембрану как осмотический барьер. Максимальной проникающей способностью обладают вода и растворенные в ней газы, значительно медленнее проникают сквозь мембрану ионы (примерно в 104 раз медленнее). Поэтому если клетку, например эритроцит, поместить в среду, где концентрация солей будет ниже, чем в клетке (гипотония), то вода снаружи устремится внутрь клетки, что приведет к увеличению объема клетки и к разрыву плазматической мембраны («гипотонический шок»). Наоборот, при помещении эритроцита в растворы солей более высокой концентрации, чем в клетке, произойдет выход воды из клетки во внешнюю среду. Клетка при этом сморщится, уменьшится в объеме.
Такой пассивный транспорт воды из клетки и в клетку все же идет с низкой скоростью. Скорость проникновения воды через мембрану составляет около 10-4 см/с, что в 100 000 раз меньше скорости диффузии молекул воды через водный слой толщиной 7,5 нм. В связи с этим было сделано заключение, что в клеточной мембране, в ее липопротеидном слое существуют специальные «поры» для проникновения воды и ионов. Число их не так велико: суммарная площадь при величине отдельной «поры» около 0,3—0,8 нм должна составлять лишь 0,06% всей клеточной поверхности.
В отличие от искусственных бислойных липидных мембран естественные мембраны, в первую очередь плазматическая мембрана, способны транспортировать ионы и многие мономеры, такие как сахара, аминокислоты и др. Проницаемость для ионов мала, причем скорость прохождения разных ионов неодинакова. Более высокая скорость прохождения для катионов (К+, Na+) и значительно ниже для анионов (Сl-).
Транспорт ионов через плазмалемму осуществляется за счет участия в этом процессе мембранных транспортных белков - пермеаз. Эти белки могут проводить в одном направлении одно вещество (унипорт) или несколько веществ одновременно (симпорт), или же вместе с импортом одного вещества выводить из клетки другое (антипорт). Так, глюкоза может входить в клетки симпортно вместе с ионом Na+.
Транспорт ионов может происходить по градиенту концентрации, пассивно, без дополнительной затраты энергии. Так, в клетку проникает ион Na+ из внешней среды, где его концентрация выше, чем в цитоплазме. В случае пассивного транспорта некоторые мембранные транспортные белки образуют молекулярные комплексы — каналы, через которые растворенные молекулы проходят через мембрану за счет простой диффузии по градиенту концентрации. Часть этих каналов открыта постоянно, а другая часть может закрываться или открываться в ответ либо на связывание с сигнальными молекулами, либо на изменение внутриклеточной концентрации ионов. В других случаях специальные мембранные белки-переносчики избирательно связываются с тем или иным ионом и переносят его через мембрану (облегченная диффузия) (рис. 131).
|
Рис. 131. Схема переноса ионов и молекул через плазматическую мембрану 1 — простая диффузия; 2 — облегченная диффузия; 3 — каналообразующий белок; 4 — белок-переносчик |
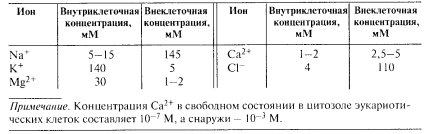
Наличие таких белковых транспортных каналов и переносчиков, казалось бы, должно приводить к уравновешиванию концентраций ионов и низкомолекулярных веществ по обе стороны мембраны. На самом же деле это не так: концентрация ионов в цитоплазме клеток резко отличается не только от таковой во внешней среде, но даже от плазмы крови, омывающей клетки в организме животных (табл. 14).
Таблица 14 |
Концентрация ионов внутри клеток и в плазме крови |
|
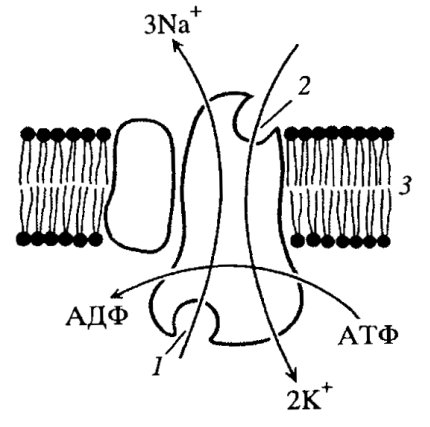
Как видно в этом случае, суммарная концентрация одновалентных катионов как внутри клеток, так и снаружи практически одинакова) (150 мМ), т.е. изотонична. Но оказывается в цитоплазме концентрация К+ почти в 50 раз выше, a Na+ ниже, чем в плазме крови. Причем это различие поддерживается только в живой клетке: если клетку убить или подавить в ней метаболические процессы, то через некоторое время ионные различия по обе стороны плазматической мембраны исчезнут. Можно просто охладить клетки до +2 °С, и через некоторое время концентрация К+ и Na+ по обе стороны от мембраны станут одинаковыми. При нагревании клеток это различие восстанавливается. Данное явление связано с тем, что в клетках существуют мембранные белковые переносчики, которые работают против градиента концентрации, затрачивая при этом энергию за счет гидролиза АТФ. Такой тип работы носит название активного транспорта, и он осуществляется с помощью белковых ионных насосов. В плазматической мембране находится двухсубъединичная молекула (K+/Na+)-нacoca, которая одновременно является и АТФазой. Этот насос при работе откачивает за один цикл три иона Na+ и закачивает в клетку два иона К+ против градиента концентрации. При этом затрачивается одна молекула АТФ, идущая на фосфорилирование АТФазы, в результате чего Na+ переносится через мембрану из клетки, а К+ получает возможность связаться с белковой молекулой и затем переносится в клетку (рис. 132). В результате активного транспорта с помощью мембранных насосов происходит также регуляция в клетке концентрации и двухвалентных катионов Mg2+ и Са2+, также с затратой АТФ.
|
Рис. 132. (K+/Na+)-нacoc 1 — участок связывания Na+; 2 — участок связывания К+; 3 — мембрана |
Такая постоянная работа пермеаз и насосов создает в клетке постоянную концентрацию ионов и низкомолекулярных веществ, т.е. создает так называемый гомеостаз — постоянство концентраций осмотически активных веществ. Надо отметить, что примерно 80% всей АТФ клетки тратится на поддержание гомеостаза.
В сочетании с активным транспортом ионов через плазматическую мембрану происходит транспорт различных сахаров, нуклеотидов и аминокислот. Так, активный транспорт глюкозы, которая симпортно (одновременно) проникает в клетку вместе с потоком пассивно транспортируемого иона Na+, будет зависеть от активности (K+/Na+)-насоса. Если этот насос заблокировать, то скоро разность концентрации Na+ по обе стороны мембраны исчезнет, сократится при этом диффузия Na+ внутрь клетки и одновременно прекратится поступление глюкозы в клетку. Как только восстановится работа (K+/Na+)-ATФaзы и возникнет разность концентрации ионов, то сразу возрастут диффузный поток Na+ и одновременно транспорт глюкозы. Подобно этому осуществляется через мембрану и поток аминокислот, которые переносятся специальными белками-переносчиками, работающими как системы симпорта, перенося одновременно ионы.
Активный транспорт сахаров и аминокислот в бактериальных клетках обусловлен градиентом ионов водорода.
Само по себе участие специальных мембранных белков в пассивном или активном транспорте низкомолекулярных соединений указывает на высокую специфичность этого процесса. Даже в случае пассивного ионного транспорта белки «узнают» данный ион, взаимодействуют с ним, связываются специфически, меняют при этом свою конформацию и функционируют. Следовательно, уже на примере транспорта простых веществ мембраны выступают как анализаторы, как рецепторы. Особенно такая рецепторная роль проявляется при поглощении клеткой биополимеров.

Везикулярный перенос: эндоцитоз и экзоцитоз
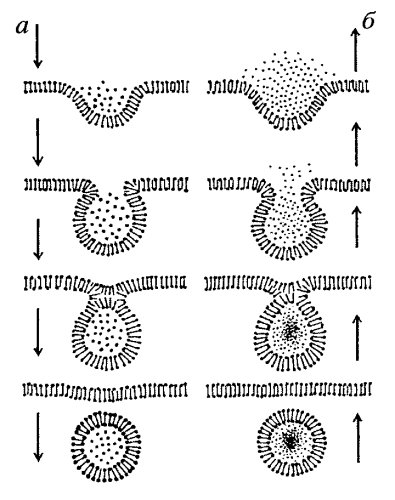
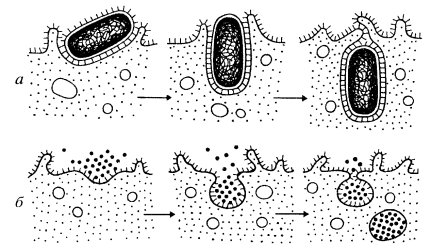
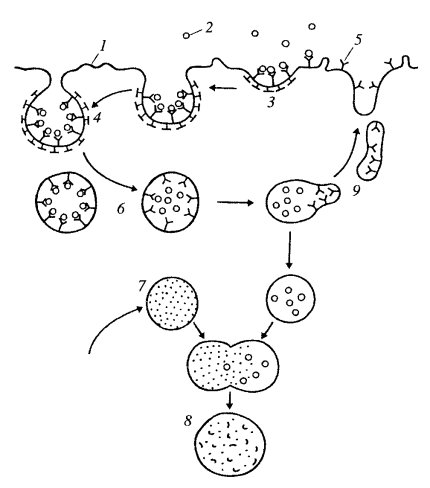
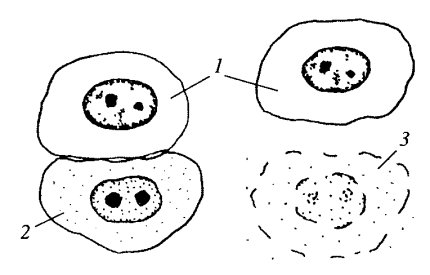
Макромолекулы, такие как белки, нуклеиновые кислоты, полисахариды, липопротеидные комплексы и другие, сквозь клеточные мембраны не проходят, в противовес тому, как транспортируются ионы и мономеры. Транспорт микромолекул, их комплексов, частиц внутрь клетки и из нее осуществляется совершенно иным путем - посредством везикулярного переноса. Этот термин означает, что различные макромолекулы, биополимеры или их комплексы не могут попадать в клетку сквозь плазматическую мембрану. И не только сквозь нее: любые клеточные мембраны не способны к трансмембранному переносу биополимеров, за исключением мембран, имеющих особые белковые комплексные переносчики - порины (мембраны митохондрий, пластид, пероксисом). В клетку же или из одного мембранного компартмента в другой макромолекулы попадают заключенными внутри вакуолей или везикул. Такой везикулярный перенос можно разделить на два вида: экзоцитоз — вынос из клетки макромолекулярных продуктов, и эндоцитоз — поглощение клеткой макромолекул (рис. 133).
|
Рис. 133. Сравнение эндоцитоза (а) и экзоцитоза (б) |
При эндоцитозе определенный участок плазмалеммы захватывает, как бы обволакивает внеклеточный материал, заключает его в мембранную вакуоль, возникшую за счет впячивания плазматической мембраны. В такую первичную вакуоль, или эндосому, могут попадать любые биополимеры, макромолекулярные комплексы, части клеток или даже целые клетки, где затем и распадаются, деполимеризуются до мономеров, которые путем трансмембранного переноса попадают в гиалоплазму. Основное биологическое значение эндоцитоза — это получение строительных блоков за счет внутриклеточного переваривания, которое осуществляется на втором этапе эндоцитоза, после слияния первичной эндосомы с лизосомой — вакуолью, содержащей набор гидролитических ферментов.
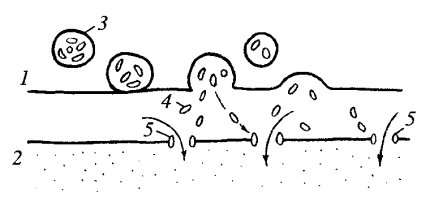
Эндоцитоз формально разделяют на пиноцитоз и фагоцитоз (рис. 134). Фагоцитоз — захват и поглощение клеткой крупных частиц (иногда даже клеток или их частей) — был впервые описан И.И. Мечниковым. Фагоцитоз встречается как у одноклеточных (например, у амебы, некоторых хищных инфузорий), так и у многоклеточных животных. В последнем случае он осуществляется с помощью специализированных клеток. Такие клетки — фагоциты, характерны как для беспозвоночных (амебоциты крови или полостной жидкости), так и для позвоночных животных (нейтрофилы и макрофаги). Пиноцитоз вначале определялся как поглощение клеткой воды или водных растворов разных веществ. Сейчас известно, что как фагоцитоз, так и пиноцитоз протекают очень сходно, и поэтому употребление этих терминов может отражать лишь различия в объемах и массе поглощенных веществ. Общее для этих процессов то, что поглощенные вещества на поверхности плазматической мембраны окружаются мембраной в виде вакуоли — эндосомы, которая перемещается внутрь клетки.
|
Рис. 134. Схема фагоцитоза (а) и пиноцитоза (б) |
Эндоцитоз, включая пиноцитоз и фагоцитоз, может быть неспецифическим, или конститутивным, постоянным и специфическим, опосредуемым рецепторами (рецепторным). Неспецифический эндоцитоз (пиноцитоз и фагоцитоз) так называется потому, что он протекает как бы автоматически и часто может приводить к захвату и поглощению совершенно чуждых или безразличных для клетки веществ, например частичек сажи или красителей.
Неспецифический эндоцитоз часто сопровождается первоначальной сорбцией захватывающего материала гликокаликсом плазмалеммы. Гликокаликс из-за кислых групп своих полисахаридов имеет отрицательный заряд и хорошо связывается с различными положительно заряженными группами белков. При таком адсорбционном неспецифическом эндоцитозе поглощаются макромолекулы и мелкие частицы (кислые белки, ферритин, антитела, вирионы, коллоидные частицы). Жлдкофазный пиноцитоз приводит к поглощению вместе с жидкой средой растворимых молекул, которые не связываются с плазмалеммой.
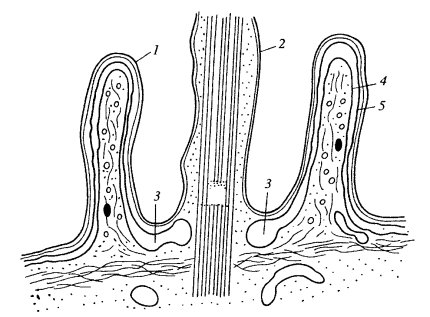
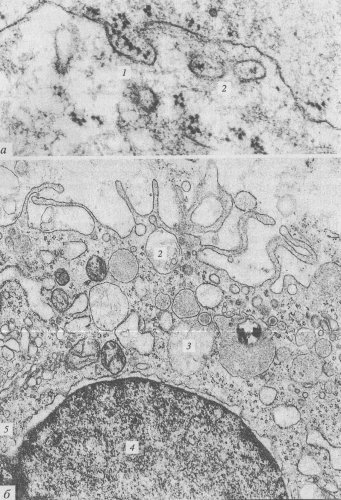
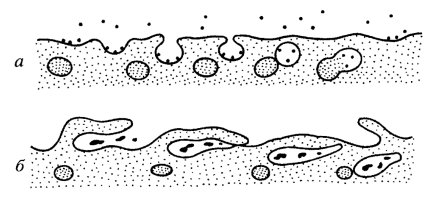
На следующем этапе происходит изменение морфологии клеточной поверхности: или возникают небольшие впячивания плазматической мембраны, т.е. инвагинации, или же на поверхности клетки появляются выросты в виде складок, или «оборок» (от английского ruffl), которые как бы захлестываются, складываются, отделяя небольшие объемы жидкой среды (рис. 135 и 136). Первый тип возникновения пиноцитозного пузырька — пиносомы, характерен для клеток кишечного эпителия, эндотелия, для амеб; второй — для фагоцитов и фибробластов. Эти процессы зависят от поступления энергии: ингибиторы дыхания блокируют эти процессы.
|
Рис. 135. Эндоцитоз (фото С.М. Коломиной) а — пиноцитозная ямка и вакуоли; б — пиноцитоз на поверхности макрофага, видны выросты цитоплазмы, образующие складки («рафлы»). 1 — пиноцитозная ямка; 2 — пиноцитозные вакуоли; 3 — эндосомы; 4 — ядро; 5 — аппарат Гольджи |
|
Рис . 136. Последовательные стадии пиноцитоза |
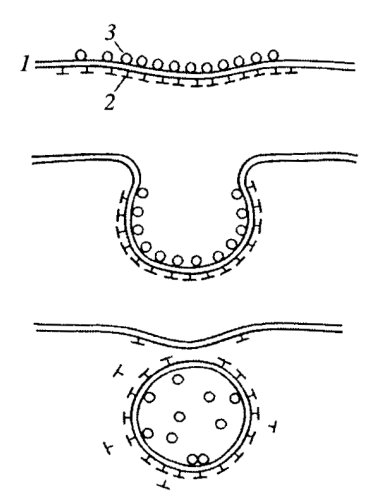
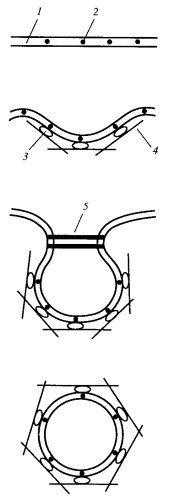
Вслед за такой перестройкой поверхности следует процесс слипания и слияния контактирующих мембран, который приводит к образованию пиноцитозного пузырька (пиносома), отрывающегося от клеточной поверхности и уходящего в глубь цитоплазмы. Как неспецифический, так и рецепторный эндоцитоз, приводящий к отщеплению мембранных пузырьков, происходит в специализированных участках плазматической мембраны. Это так называемые окаймленные ямки. Они называются так потому, что со стороны цитоплазмы плазматическая мембрана покрыта (одета) тонким (около 20 нм) волокнистым слоем, который на ультратонких срезах как бы окаймляет, покрывает небольшие впячивания — ямки (рис. 137). Эти ямки есть почти у всех клеток животных, они занимают около 2% клеточной поверхности. Окаймляющий слой состоит в основном из белка клатрина, ассоциированного с рядом дополнительных белков. Три молекулы клатрина вместе с тремя молекулами низкомолекулярного белка образуют структуру трискелиона, напоминающего трехлучевую свастику (рис. 138). Клатриновые трискелионы на внутренней поверхности ямок плазматической мембраны образуют рыхлую сеть, состоящую из пяти- и шестиугольников, в целом напоминающую корзинку. Клатриновый слой одевает весь периметр отделяющихся первичных эндоцитозных вакуолей — окаймленных пузырьков.
|
Рис. 137. Окаймленные ямки и вакуоли Последовательные стадии связывания лигандов и образование вакуолей: 1 — плазматическая мембрана, 2 — клатриновый слой («кайма»), 3 — сорбированные лиганды |
|
Рис. 138. Окаймленные пузырьки а — вид со стороны цитозоля; б — трискелеоны на поверхности пузырька |
Клатрин относится к одному из видов так называемых одевающих белков (СОР — coated proteins). Эти белки связываются с интегральными белками-рецепторами со стороны цитоплазмы и образуют одевающий слой по периметру возникающей пиносомы, первичного эндосомного пузырька, т.е. «окаймленного» пузырька. В отделении первичной эндосомы участвуют также белки - динамины, которые полимеризуются вокруг шейки отделяющегося пузырька (рис. 139).
|
Рис. 139. Последовательные стадии образования и отщепления окаймленного пузырька 1 — плазматическая мембрана; 2 — интегральные белки; 3 — кэпирующие белковые частицы; 4 — клатрин; 5 — дииамин |
После того как окаймленный пузырек отделится от плазмалеммы и начнет переноситься в глубь цитоплазмы, клатриновый слой распадается, диссоциирует, мембрана эндосом (пиносом) приобретает обычный вид. После потери клатринового слоя эндосомы начинают сливаться друг с другом.
Мембраны окаймленных ямок содержат сравнительно мало холестерина, что может определять снижение жесткости мембран и способствовать образованию пузырьков. Биологический смысл появления клатриновой «шубы» по периферии пузырьков, возможно, заключается в том, что он обеспечивает сцепление окаймленных пузырьков с элементами цитоскелета и последующий их транспорт в клетке, а также препятствует их слиянию друг с другом.
Интенсивность жидкофазного неспецифического пиноцитоза может быть очень высокой. Так, клетка эпителия тонкого кишечника образует до 1000 пиносом в секунду, а макрофаги — около 125 пиносом в минуту. Размер пиносом невелик, их нижний предел составляет 60-130 нм, но обилие их приводит к тому, что при эндоцитозе плазмалемма быстро замещается, как бы «тратится» на образование множества мелких вакуолей. Например, у макрофагов вся плазматическая мембрана заменяется за 30 мин, у фибробластов — за 2 ч.
Дальнейшая судьба эндосом может быть различной, часть из них может возвращаться к поверхности клетки и сливаться с ней, но большая часть вступает в процесс внутриклеточного пищеварения. Первичные эндосомы содержат в основном захваченные в жидкой среде чужеродные молекулы и не содержат гидролитических ферментов. Эндосомы могут сливаться друг с другом, при этом увеличиваясь в размере. Они затем сливаются с первичными лизосомами, которые вводят в полость эндосом ферменты, гидролизующие различные биополимеры. Действие этих лизосомных гидролаз и вызывает внутриклеточное пищеварение - распад полимеров до мономеров.
Как уже указывалось, в ходе фагоцитоза и пиноцитоза клетки теряют большую площадь плазмалеммы (см. макрофаги), которая, однако, довольно быстро восстанавливается при рециклизации мембран, за счет возвращения вакуолей и их встраивания в плазмалемму. Это происходит вследствие того, что от эндосом или вакуолей, так же как и от лизосом, могут отделяться небольшие пузырьки, которые вновь сливаются с плазмалеммой. При такой рециклизации происходит как бы «челночный» перенос мембран: плазмалемма—пиносома—вакуоль—плазмалемма. Это ведет к восстановлению исходной площади плазматической мембраны. При таком возврате — рециклизации мембран, в оставшейся эндосоме удерживается весь поглощенный материал.
Специфический, или опосредуемый рецепторами, эндоцитоз имеет ряд отличий от неспецифического. Главное в том, что поглощаются молекулы, для которых на плазматической мембране есть специфические рецепторы, ассоциирующиеся только с данным типом молекул. Часто такие молекулы, связывающиеся с белками-рецепторами на поверхности клеток, называют лигандами.
Впервые опосредуемый рецепторами эндоцитоз был описан при накоплении белков в ооцитах птиц. Белки желточных гранул - вителлогенины, синтезируются в различных тканях, но затем с током крови попадают в яичники, где связываются со специальными мембранными рецепторами ооцитов и затем с помощью эндоцитоза попадают внутрь клетки, где и происходит отложение желточных гранул.
Другой пример избирательного эндоцитоза представляет собой транспорт в клетку холестерина. Этот липид синтезируется в печени и в комплексе с другими фосфолипидами и белковой молекулой образует так называемый липопротеид низкой плотности (ЛНП), который секретируется клетками печени и с кровью разносится по всему телу (рис. 140). Специальные рецепторы плазматической мембраны, диффузно расположенные на поверхности различных клеток, узнают белковый компонент ЛНП и образуют специфический комплекс рецептор-лиганд. Вслед за этим такой комплекс перемещается в зону окаймленных ямок и интернализуется - окружается мембраной и погружается в глубь цитоплазмы. Показано, что мутантные рецепторы могут связывать ЛНП, но не аккумулируются в зоне окаймленных ямок. Кроме рецепторов к ЛНП обнаружено более двух десятков других, участвующих в рецепторном эндоцитозе различных веществ. Все они используют один и тот же путь интернализации через окаймленные ямки. Вероятно, их роль заключается в накапливании рецепторов: одна и та же окаймленная ямка может собрать около 1000 рецепторов разного класса. Однако у фибробластов кластеры рецепторов ЛНП расположены в зоне окаймленных ямок даже в отсутствие лиганда в среде.
|
Рис. 140. Поступление в клетку ЛНП с помощью опосредуемого рецепторами эндоцитоза 1 — плазмалемма; 2 — частица ЛНП; 3 — окаймленная ямка; 4 — окаймленный пузырек; 5 — рецептор ЛНП; 6 — эндосома; 7 — первичная лизосома; 8 — вторичная лизосома; 9 — рециклизация рецепторов ЛНП |
Дальнейшая судьба поглощенной частицы ЛНП заключается в том, что она подвергается распаду в составе вторичной лизосомы. После погружения в цитоплазму окаймленного пузырька, нагруженного ЛНП, происходит быстрая потеря клатринового слоя, мембранные пузырьки начинают сливаться друг с другом, образуя эндосому — вакуоль, содержащую поглощенные ЛНП-частицы, связанные еще с рецепторами на поверхности мембраны. Затем происходит диссоциация комплекса лиганд—рецептор; от эндосомы отщепляются мелкие вакуоли, мембраны которых содержат свободные рецепторы. Эти пузырьки рециклируются, включаются в плазматическую мембрану, и тем самым рецепторы возвращаются на поверхность клетки. Судьба же ЛНП состоит в том, что после слияния с лизосомами они гидролизуются до свободного холестерина, который может включаться в клеточные мембраны.
Эндосомы характеризуются более низким значением рН (4-5), более кислой средой, чем другие клеточные вакуоли. Это связано с наличием в их мембранах белков протонного насоса, закачивающих ионы водорода с одновременной затратой АТФ (Н+-зависимая АТФаза). Кислая среда внутри эндосом играет решающую роль в диссоциации рецепторов и лигандов. Кроме того, кислая среда является оптимальной для активации гидролитических ферментов в составе лизосом, которые активируются при слиянии лизосом с эндосомами, что приводит к образованию эндолизосомы, где и происходит расщепление поглощенных биополимерв.
В некоторых случаях судьба диссоциированных лигандов не связана с лизосомным гидролизом. Так, в некоторых клетках после связывания рецепторов плазмалеммы с определенными белками покрытые клатрином вакуоли погружаются в цитоплазму и переносятся к другой области клетки, где сливаются снова с плазматической мембраной, а связанные белки диссоциируют от рецепторов. Так осуществляется перенос — трансцитозис, некоторых белков через стенку эндотелиальной клетки из плазмы крови в межклеточную среду (рис. 141). Другой пример трансцитоза - перенос антител. Так, у млекопитающих антитела матери могут передаваться детенышу через молоко. В этом случае комплекс рецептор-антитело остается в эндосоме без изменений.
|
Рис. 141. Трансцитоз — перенос (1) веществ мембранными вакуолями сквозь стенку эндотелиальной клетки 2 — пиноцитозные вакуоли; 3 — просвет капилляра; 4 — цитоплазма; 5 — ядро |
Как уже говорилось, фагоцитоз является вариантом эндоцитоза и связан с поглощением клеткой крупных агрегатов макромолекул, вплоть до живых или мертвых клеток. Так же как и пиноцитоз, фагоцитоз может быть неспецифическим (например, поглощение фибробластами или макрофагами частичек коллоидного золота или полимера декстрана) и специфическим, опосредуемым рецепторами на поверхности плазматической мембраны фагоцитирующих клеток. При фагоцитозе происходит образование больших эндоцитозных вакуолей — фагосом, которые затем, сливаясь с лизосомами, образуют фаголизосомы.
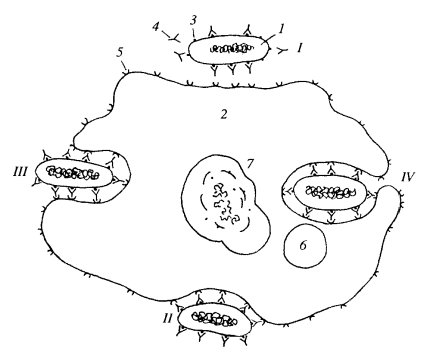
На поверхности клеток, способных к фагоцитозу (у млекопитающих это нейтрофилы и макрофаги), существует набор рецепторов, взаимодействующих с белками-лигандами. Так, при бактериальных инфекциях антитела к белкам бактерий связываются с поверхностью бактериальных клеток, образуя слой, в котором Fc-области антител смотрят наружу. Этот слой узнается специфическими рецепторами на поверхности макрофагов и нейтрофилов, и в местах их связывания начинается поглощение бактерии путем обволакивания ее плазматической мембраной клетки (рис. 142).
|
Рис. 142. Последовательность (I—IV) захвата макрофагом бактериальной клетки 1 — бактерия; 2 — макрофаг; 3 — антиген поверхности бактерии; 4 — антитела; 5 — рецепторы на плазматической мембране макрофага; 6 — лизосома; 7 — деградация бактериальной клетки в лизосоме |
Плазматическая мембрана принимает участие в выведении веществ из клетки с помощью экзоцитоза — процесса, обратного эндоцитозу (см. рис. 133). В случае экзоцитоза внутриклеточные продукты, заключенные в вакуоли или пузырьки и отграниченные от гиалоплазмы мембраной, подходят к плазматической мембране. В местах их контактов плазматическая мембрана и мембрана вакуоли сливаются, и пузырек опустошается в окружающую среду. С помощью экзоцитоза происходит процесс рециклизации мембран, участвующих в эндоцитозе.
С экзоцитозом связано выделение синтезированных в клетке разнообразных веществ. Секретирующие, т.е. выделяющие вещества во внешнюю среду, клетки могут вырабатывать и выбрасывать низкомолекулярные соединения (ацетилхолин, биогенные амины и др.), а также в большинстве случаев макромолекулы (пептиды, белки, липопротеиды, пептидогликаны и др.). Экзоцитоз, или секреция, в большинстве случаев осуществляется в ответ на внешний сигнал (нервный импульс, воздействие гормона, медиатора и др.), хотя в ряде случаев экзоцитоз происходит постоянно (секреция фибронектина и коллагена фибробластами). Сходным образом из цитоплазмы растительных клеток выводятся некоторые полисахариды (гемицеллюлозы), участвующие в образовании клеточных стенок.
Большинство секретируемых веществ используется другими клетками многоклеточных организмов (секреция молока, пищеварительных соков, гормонов и др.). Но часто клетки секретируют вещества и для собственных нужд. Например, рост плазматической мембраны осуществляется за счет встраивания участков мембраны в составе экзоцитозных вакуолей, часть элементов гликокаликса выделяется клеткой в виде гликопротеидных молекул и т.д.
Выделенные из клеток путем экзоцитоза гидролитические ферменты могут сорбироваться в слое гликокаликса и обеспечивать примембранное внеклеточное расщепление различных биополимеров и органических молекул. Огромное значение примембранное неклеточное пищеварение имеет для животных. Обнаружено, что в кишечном эпителии млекопитающих в зоне так называемой щеточной каемки всасывающего эпителия, особенно богатой гликокаликсом, обнаруживается огромное количество разнообразных ферментов. Часть этих же ферментов имеет панкреатическое происхождение (амилаза, липазы, различные протеиназы и др.), а часть выделяется собственно клетками эпителия (экзогидролазы, расщепляющие преимущественно олигомеры и димеры с образованием транспортируемых продуктов).

Рецепторная роль плазмалеммы
Мы уже встречались с этой особенностью плазматической мембраны при ознакомлении с ее транспортными функциями. Белки-переносчики и насосы являются кроме всего также рецепторами, узнающими и взаимодействующими с определенными ионами. Рецепторные белки связываются с лигандами и участвуют в отборе молекул, поступающих в клетки.
В качестве таких рецепторов на поверхности клетки могут выступать белки мембраны или элементы гликокаликса - гликопротеиды. Такие чувствительные к отдельным веществам участки могут быть разбросаны по поверхности клетки или собраны в небольшие зоны.
Разные клетки животных организмов могут обладать разными наборами рецепторов или же разной чувствительностью одного и того же рецептора.
Роль многих клеточных рецепторов заключается не только в связывании специфических веществ или способности реагировать на физические факторы, но и в передаче межклеточных сигналов с поверхности внутрь клетки. В настоящее время хорошо изучена система передачи сигнала клеткам с помощью некоторых гормонов, в состав которых входят пептидные цепочки. Эти гормоны связываются со специфическими рецепторами на поверхности плазматической мембраны клетки. Рецепторы после связи с гормоном активируют другой белок, лежащий уже в цитоплазматической части плазматической мембраны, - аденилатциклазу. Этот фермент синтезирует молекулу циклического АМФ из АТФ. Роль циклического АМФ (цАМФ) заключается в том, что он является вторичным мессенджером — активатором ферментов киназ, вызывающих модификации других белков-ферментов. Так, при действии на печеночную клетку гормона поджелудочной железы глюкагона, вырабатываемого А-клетками островков Лангерганса, он связывается со специфическим рецептором, что стимулирует активацию аденилатциклазы. Синтезированный цАМФ активирует протеинкиназу А, которая в свою очередь активирует каскад ферментов, в конечном счете расщепляющих гликоген (запасной полисахарид животных) до глюкозы. Действие инсулина заключается в обратном: он стимулирует вхождение глюкозы в печеночные клетки и отложение ее в виде гликогена.
В целом цепь событий развертывается следующим образом: гормон взаимодействует специфически с рецепторной частью этой системы и, не проникая внутрь клетки, активирует аденилатциклазу, которая синтезирует цАМФ. Последний активирует или ингибирует внутриклеточный фермент или группу ферментов. Таким образом, команда (сигнал от плазматической мембраны) передается внутрь клетки. Эффективность этой аденилатциклазной системы очень высока. Так, взаимодействие одной или нескольких молекул гормона может привести за счет синтеза множества молекул цАМФ к усилению сигнала в тысячи раз. В данном случае аденилатциклазная система служит преобразователем внешних сигналов.
Существует и другой путь, при котором используются другие вторичные мессенджеры, — это так называемый фосфатидилинозитольный путь. Под действием соответствующего сигнала (некоторые нервные медиаторы и белки) активируется фермент фосфолипаза С, которая расщепляет фосфолипид фосфатидилинозитолдифосфат, который входит в состав плазматической мембраны. Продукты гидролиза этого липида, с одной стороны, активируют протеинкиназу С, которая вызывает активацию каскада киназ, что приводит к определенным клеточным реакциям, а с другой — приводит к освобождению ионов кальция, который регулирует целый ряд клеточных процессов.
Другой пример рецепторной активности - рецепторы ацетилхолина, важного нейромедиатора. Ацетилхолин, освобождаясь из нервного окончания, связывается с рецептором на мышечном волокне, что вызывает импульсное поступление Na+ в клетку (деполяризация мембраны), открывая сразу около 2000 ионных каналов в зоне нервно-мышечного окончания.
Разнообразие и специфичность наборов рецепторов на поверхности клеток приводят к созданию очень сложной системы маркеров, позволяющих отличать свои клетки (той же особи или того же вида) от чужих. Сходные клетки вступают друг с другом во взаимодействия, приводящие к слипанию поверхностей (конъюгация у простейших и бактерий, образование тканевых клеточных комплексов). При этом клетки, отличающиеся набором детерминантных маркеров или не воспринимающие их, либо исключаются из такого взаимодействия, либо (у высших животных) уничтожаются в результате иммунологических реакций.
С плазматической мембраной связана локализация специфических рецепторов, реагирующих на физические факторы. Так, в плазматической мембране или в ее производных у фотосинтетических бактерий и синезеленых водорослей локализованы белки-рецепторы (хлорофиллы), взаимодействующие с квантами света. В плазматической мембране светочувствительных клеток животных расположена специальная система фоторецепторных белков (родопсин), с помощью которых световой сигнал превращается в химический, что в свою очередь приводит к генерации электрического импульса.

Межклеточное узнавание
У многоклеточных организмов за счет межклеточных взаимодействий образуются сложные клеточные ансамбли, поддержание которых может осуществляться разными путями. В зародышевых, эмбриональных тканях, особенно на ранних стадиях развития, клетки остаются в связи друг с другом за счет способности их поверхностей слипаться. Это свойство адгезии (соединения, сцепления) клеток может определяться свойствами их поверхности, которые специфически взаимодействуют друг с другом. Механизм этих связей достаточно хорошо изучен, он обеспечивается взаимодействием между гликопротеидами плазматических мембран. При таком межклеточном взаимодействии клеток между плазматическими мембранами всегда остается щель шириной около 20 нм, заполненная гликокаликсом. Обработка ткани ферментами, нарушающими целостность гликокаликса (муказами, действующими гидролитически на муцины, мукополисахариды) или повреждающими плазматическую мембрану (протеазами), приводит к обособлению клеток друг от друга, к их диссоциации. Однако если удалить фактор диссоциации, то клетки могут снова собираться, реагрегировать. Так можно диссоциировать клетки разных по окраске губок, оранжевых и желтых. Оказалось, что в смеси этих клеток образуются два типа агрегатов: одни состоят только из желтых, другие - только из оранжевых клеток. При этом смешанные клеточные суспензии самоорганизуются, восстанавливая исходную многоклеточную структуру. Сходные результаты были получены с суспензиями разделенных клеток эмбрионов амфибий; в этом случае происходит избирательное пространственное обособление клеток эктодермы от энтодермы и от мезенхимы. Более того, если для реагрегации используются ткани поздних стадий развития зародышей, то в пробирке самостоятельно собираются различные клеточные ансамбли, обладающие тканевой и органной специфичностью, образуются эпителиальные агрегаты, сходные с почечными канальцами, и т.д.
За агрегацию однородных клеток отвечают трансмембранные гликопротеиды. Непосредственно за соединение — адгезию, клеток отвечают молекулы так называемых САМ-белков (cell adhesion molecules). Некоторые из них связывают клетки друг с другом за счет межмолекулярных взаимодействий, другие образуют специальные межклеточные соединения, или контакты.
Взаимодействия между адгезивными белками могут быть гомофильными, когда соседние клетки связываются друг с другом с помощью однородных молекул, и гетерофильными, когда в адгезии участвуют разного рода САМ на соседних клетках. Встречается межклеточное связывание через дополнительные линкерные молекулы.
Имеется несколько классов САМ-белков: кадгерины, иммуноглобулиноподобные N-CAM (молекулы адгезии нервных клеток), селектины, интегрины.
Кадгерины представляют собой интегральные фибриллярные мембранные белки, которые образуют параллельные гомодимеры. Отдельные домены этих белков связаны с ионами Са2+, что придает им определенную жесткость. Насчитывают более 40 видов кадгеринов. Так, Е-кадгерин характерен для клеток преимплантированных эмбрионов и для эпителиальных клеток взрослых организмов. Р-кадгерин характерен для клеток трофобласта, плаценты и эпидермиса, N-кадгерин располагается на поверхности нервных клеток, клеток хрусталика, на сердечных и скелетных мышцах.
Молекулы адгезии нервных клеток (N-CAM) принадлежат к суперсемейству иммуноглобулинов, они образуют связи между нервными клетками. Некоторые из N-CAM участвуют в соединении синапсов, а также при адгезии клеток иммунной системы.
Селектины — интегральные белки плазматической мембраны, участвуют в адгезии эндотелиальных клеток, в связывании кровяных пластинок, лейкоцитов.
Интегрины представляют собой гетеродимеры, с α и β-цепями. Интегрины в первую очередь осуществляют связь клеток с внеклеточными субстратами, но могут участвовать и в адгезии клеток друг с другом.
Как уже указывалось, на попавшие в организм чужеродные макромолекулы (антигены) развивается сложная комплексная реакция - иммунная реакция. Суть ее заключается в том, что часть лимфоцитов вырабатывает специальные белки-антитела, которые специфически связываются с антигенами. Так, макрофаги своими поверхностными рецепторами узнают комплексы антиген—антитело и поглощают их (например, поглощение бактерий при фагоцитозе).
В организме всех позвоночных, кроме того, существует система рецепции чужеродных клеток или же своих, но с измененными белками плазматической мембраны, например при вирусных инфекциях или при мутациях, часто связанных с опухолевым перерождением клеток.
На поверхности всех клеток позвоночных располагаются белки так называемого главного комплекса гистосовместимости (МНС - major histocompatibility complex). Это интегральные белки гликопротеины, гетеродимеры. Очень важно запомнить, что каждый индивидуум имеет свой набор таких белков МНС. Это связано с тем, что они очень полиморфны, так как в каждом индивидуме имеется большое число альтернативных форм одного и того же гена (более 100); кроме того, имеется 7—8 локусов, кодирующих молекулы МНС. Это приводит к тому, что каждая клетка данного организма, имея набор белков МНС, будет отличаться от клеток индивидуума этого же вида. Специальная форма лимфоцитов — Т-лимфоциты, узнают МНС своего организма, но малейшие изменения в структуре МНС (например, связь с вирусом или результат мутации в отдельных клетках) приводят к тому, что Т-лимфоциты узнают такие изменившиеся клетки и уничтожают их, но не путем фагоцитоза. Они выделяют из секреторных вакуолей специфические белки-перфорины, которые встраиваются в цитоплазматическую мембрану измененной клетки, образуют в ней трансмембранные каналы, делая плазматическую мембрану проницаемой, что и приводит к гибели измененной клетки (рис. 143 и 144).
|
Рис. 143. Атака Т-лимфоцита (1) на чужеродную клетку (2), которая подвергается лизису (3) |
|
Рис. 144. Выделение из вакуолей (3) Т-лимфоцита (1) белков- перфоринов (4), которые встраиваются в плазматическую мембрану клетки-мишени (2) и образуют в ней каналы (5) |

Специальные межклеточные соединения (контакты)
Кроме таких сравнительно простых адгезивных (но специфических) связей (рис. 145) существует целый ряд специальных межклеточных структур - контактов, или соединений, которые выполняют определенные функции. Это запирающие, заякоривающие и коммуникационные соединения (рис. 146).
|
Рис. 145. Схема простого межклеточного соединения а — простое соединение, без участия специальных структур; б — трансмембранные гликопротеиды определяют связывание двух соседних клеток |
|
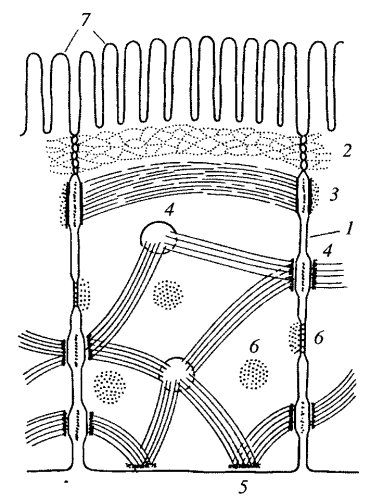
Рис. 146. Расположение различных адгезивных соединений в энтероците 1 — простое соединение; 2 — плотное соединение; 3 — адгезивный поясок; 4 — десмосома; 5 — полудесмосома; 6 — щелевое соединение; 7 — микроворсинки |
Запирающее, или плотное, соединение характерно для однослойных эпителиев. Это зона, где внешние слои двух плазматических мембран максимально сближены. Часто видна трехслойность мембраны в этом контакте: два внешних осмофильных слоя обеих мембран как бы сливаются в один общий слой толщиной 2-3 нм. Слияние мембран происходит не по всей площади плотного контакта, а представляет собой ряд точечных сближений мембран (рис. 147, а и 148).
|
Рис. 147. Межклеточные специальные соединения (контакты) а — плотный запирающий контакт (tight junction): 1 — плазматическая мембрана одной из соединяющихся клеток, 2 — сближение мембран в зоне контакта; б — нексус — щелевой контакт (1) между двумя (2 и 3) кардиомиоцитами |
|
Рис. 148. Схема плотного соединения а — расположение плотного соединения (вставочная пластинка) на клетках (1) кишечного эпителия; б — трехмерная схема участка плотного соединения: 1 — плазматические мембраны соседних клеток, 2 — глобулы белка окклюдина |
На плоскостных препаратах разломов плазматической мембраны в зоне плотного контакта с помощью метода замораживания и скалывания было обнаружено, что точки соприкосновения мембран представляют собой ряды глобул. Это белки окклудин и клаудин — специальные интегральные белки плазматической мембраны, встроенные рядами. Такие ряды глобул, или полоски, могут пересекаться так, что образуют на поверхности скола как бы решетку, или сеть. Очень характерна эта структура для эпителиев, особенно железистых и кишечных. В последнем случае плотный контакт образует сплошную зону слияния плазматических мембран, опоясывающую клетку в апикальной (верхней, смотрящей в просвет кишечника) ее части (см. рис. 148). Таким образом, каждая клетка пласта как бы обведена лентой этого контакта. Такие структуры при специальных окрасках можно видеть и в световом микроскопе. Они получили у морфологов название замыкающих пластинок. Оказалось, что в данном случае роль замыкающего плотного контакта заключается не только в механическом соединении клеток друг с другом. Эта область контакта плохо проницаема для макромолекул и ионов, и тем самым она запирает, перегораживает межклеточные полости, изолируя их (и вместе с ними собственно внутреннюю среду организма) от внешней среды (в данном случае — просвет кишечника).
Это можно продемонстрировать, используя электронно-плотные контрастеры, например раствор гидроокиси лантана. Если просвет кишечника или протока какой-нибудь железы наполнить раствором гидроокиси лантана, то на срезах под электронным микроскопом зоны, где располагается это вещество, обладают высокой электронной плотностью и будут темными. Оказалось, что ни зона плотного контакта, ни межклеточные пространства, лежащие ниже его, не темнеют. Если же повредить плотные контакты (легкой ферментативной обработкой или удалением ионов Са2+), то лантан проникает и в межклеточные участки. Точно так же была доказана непроницаемость плотных контактов для гемоглобина и ферритина в канальцах почек. Таким образом, плотные контакты являются барьерами не только для макромолекул, они непроницаемы для жидкостей и ионов.
Замыкающий, или плотный, контакт встречается между всеми типами однослойного эпителия (эндотелий, мезотелий, эпендима).
Заякоривающие, или сцепляющие, соединения, или контакты, так называются потому, что они соединяют не только плазматические мембраны соседних клеток, но и связываются с фибриллярными элементами цитоскелета (рис. 149). Для этого рода соединений характерным является наличие двух типов белков. Первый тип представлен трансмембранными линкерными (связующими) белками, которые участвуют или в собственно межклеточном соединении или в соединении плазмалеммы с компонентами внеклеточного матрикса (базальная мембрана эпителиев, внеклеточные структурные белки соединительной ткани).
|
Рис. 149. Схема строения заякоривающих адгезивных соединений 1 — плазматическая мембрана; 2 — трансмембранные линкерные гликопротеиды; 3 — внутриклеточные белки сцепления; 4 — элементы цитоскелета |
Ко второму типу относятся внутриклеточные белки, соединяющие, или заякоривающие, мембранные элементы такого контакта с цитоплазматическими фибриллами цитоскелета.
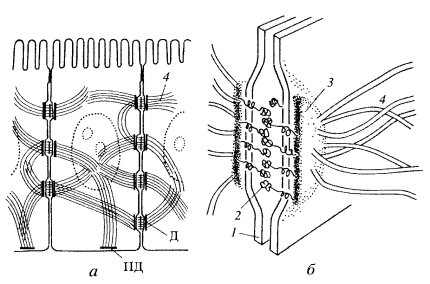
К заякоривающим соединениям относятся межклеточные сцепляющие точечные контакты, сцепляющие ленты, фокальные контакты, или бляшки сцепления; все эти контакты связываются внутри клеток с актиновыми микрофиламентами. Другую группу заякоривающих межклеточных соединений составляют десмосомы и полудесмосомы; они связываются с другими элементами цитоскелета — с промежуточными филаментами.
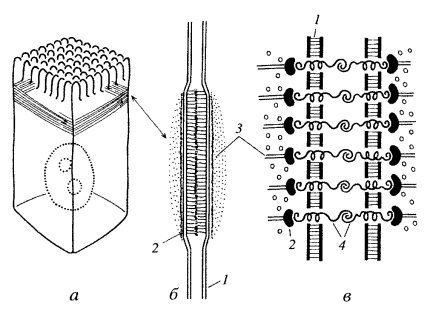
Межклеточные точечные сцепляющие соединения обнаружены у многих неэпителиальных тканей, но более отчетливо описана структура сцепляющих (адгезивных) лент в однослойных эпителиях (рис. 150). Эта структура опоясывает весь периметр эпителиальной клетки, подобно тому как это происходит в случае плотного соединения. Чаще всего такой поясок, или лента, лежит ниже плотного соединения (см. рис. 146). В этом месте плазматические мембраны не сближены, а даже несколько раздвинуты на расстояние 25—30 нм, и между ними видна зона повышенной плотности. Это не что иное, как места взаимодействия трансмембранных гликопротеидов, которые специфически сцепляются друг с другом и обеспечивают механическое соединение мембран двух соседних клеток. Эти линкерные белки относятся к Е-кадгеринам — белкам, обеспечивающим специфическое узнавание клетками однородных мембран. Разрушение этого слоя гликопротеидов приводит к обособлению отдельных клеток и к разрушению эпителиального пласта. С цитоплазматической стороны около мембраны видно скопление какого-то плотного вещества, к которому примыкает слой тонких (6—7 нм) филаментов, лежащих вдоль плазматической мембраны в виде пучка, идущего по всему периметру клетки. Тонкие филаменты относятся к актиновым фибриллам, они связываются с плазматической мембраной посредством белков катенина, винкулина и α-актинина, образующих плотный околомембранный слой.
|
Рис. 150. Адгезивный (сцепляющий) поясок (лента) а — расположение его в клетке; 6 — вид на ультратонком срезе; в — схематическое изображение. 1 — плазматическая мембрана; 2 — слой винкулина; 3 — актиновые микрофиламенты; 4 — линкерные гликопротеиды |
Функциональное значение такого ленточного соединения заключается не только в механическом сцеплении клеток друг с другом: при сокращении актиновых филаментов в ленте может изменяться форма клетки. Считается, что кооперативное сокращение актиновых фибрилл во всех клетках эпителиального пласта может вызвать изменение его геометрии, например сворачивание в трубку, подобно тому, что происходит при образовании нервной трубки у эмбрионов позвоночных.
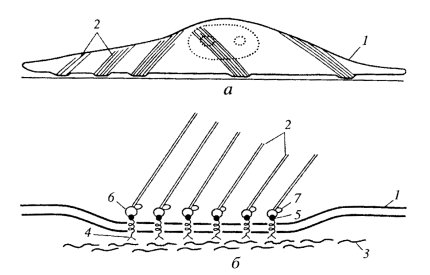
Фокальные контакты, или бляшки сцепления, встречаются у многих клеток и особенно хорошо изучены у фибробластов. Они построены по общему плану со сцепляющими лентами, но выражены в виде не больших участков — бляшек — на плазмалемме. В этом случае трансмембранные линкерные белки-интегрины специфически связываются с белками внеклеточного матрикса (например, с фибронектином) (рис. 151). Со стороны цитоплазмы эти же гликопротеиды связаны с примембранными белками, куда входит и винкулин, который в свою очередь связан с пучком актиновых филаментов. Функциональное значение фокальных контактов заключается как в закреплении клетки на внеклеточных структурах, так и в создании механизма, позволяющего клеткам перемещаться.
|
Рис. 151. Фокальный контакт а — расположение в фибробласте; 6 — молекулярная схема. 1 — плазматическая мембрана; 2 — микрофиламенты; 3 — фибронектин; 4 — рецептор фибронектина; 5 — талин; 6 — винкулин; 7 — α-актинин |
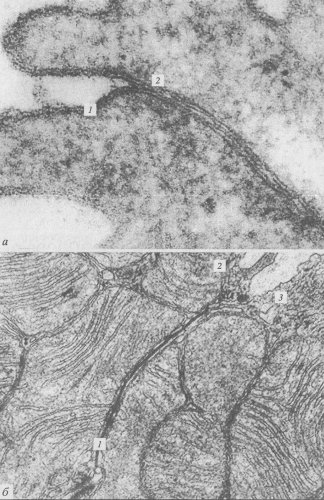
Десмосомы — структуры в виде бляшек или кнопок, также соединяют клетки друг с другом (рис. 152 и 153, а). В межклеточном пространстве здесь также виден плотный слой, представленный взаимодействующими интегральными мембранными кадгеринами — десмоглеинами, которые сцепляют клетки друг с другом. С цитоплазматической стороны к плазмалемме прилежит слой белка-десмоплакина, с которым связаны промежуточные филаменты цитоскелета. Десмосомы встречаются чаще всего в эпителиях, в этом случае промежуточные филаменты содержат кератины. Клетки сердечной мышцы — кардиомиоциты, содержат десминовые фибриллы в составе десмосом. В эндотелии сосудов в состав десмосом входят виментиновые промежуточные филаменты.
|
Рис. 152. Десмосома а — расположение в клетке; 6 — молекулярная схема. 1 — плазматическая мембрана; 2 — десмоглеиновый слой; 3 — слой десмоплакина; 4 — промежуточные филаменты. Д — десмосома; ПД — полудесмосома |
|
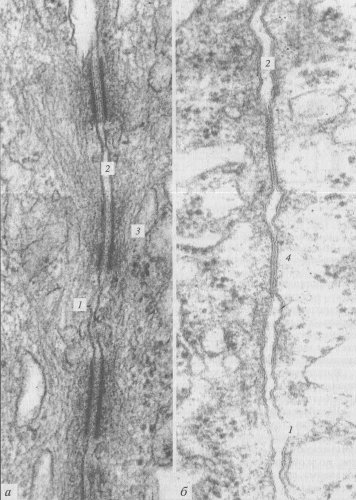
Рис. 153. Микрофотография межклеточных соединений (контактов) в клетках печени, полученная с помощью электронного микроскопа а — десмосомы; б — щелевые соединения. 1 — плазматическая мембрана; 2 — межклеточное пространство; 3 — десмосома; 4 — щелевой контакт |
Полудесмосомы в принципе сходны по строению с десмосомой, но представляют собой соединение клеток с межклеточными структурами. Так, в эпителиях линкерные гликопротеиды (интегрины) десмосомы взаимодействуют с белками так называемой базальной мембраны, куда входят коллаген, ламинин, протеогликаны и др.
Функциональная роль десмосом и полудесмосом сугубо механическая — они сцепляют клетки друг с другом и с подлежащим внеклеточным матриксом прочно, что позволяет эпителиальным пластам выдерживать большие механические нагрузки. Подобно этому десмосомы прочно связывают друг с другом клетки сердечной мышцы, что позволяет им выполнять огромную механическую нагрузку, оставаясь связанными в единую сокращающуюся структуру.
В отличие от плотного контакта все типы сцепляющих контактов проницаемы для водных растворов и не играют никакой роли в ограничении диффузии.
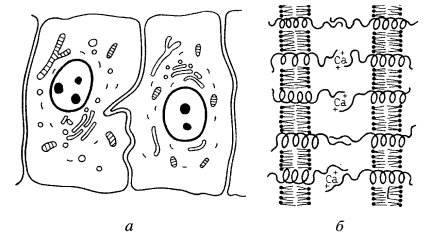
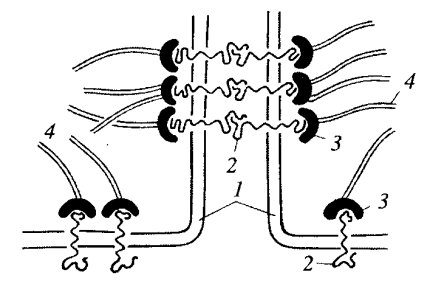
Щелевые контакты считаются коммуникационными соединениями клеток. Эти структуры участвуют в прямой передаче химических веществ из клетки в клетку, что может не только играть большую физиологическую роль при функционировании специализированных клеток, но и обеспечивать межклеточные взаимодействия при развитии организма, при дифференцировке его клеток. Характерным для этого типа контактов является сближение плазматических мембран двух соседних клеток на расстояние 2—3 нм (см. рис. 147, б и 153, б). Именно это обстоятельство долгое время не позволяло на ультратонких срезах отличить данный вид контакта от плотного разделительного (замыкающего) контакта. При использовании гидроокиси лантана было замечено, что некоторые плотные контакты пропускают контрастер. В этом случае лантан заполнял тонкую щель шириной около 3 нм между сближенными плазматическими мембранами соседних клеток. Это и послужило появлению термина щелевой контакт. Дальнейший прогресс в расшифровке его строения был достигнут при использовании метода замораживания-скалывания. Оказалось, что на сколах мембран зоны щелевых контактов (размером от 0,5 до 5 мкм) усеяны гексагонально расположенными (с периодом 8—10 нм) частицами 7—8 нм в диаметре, имеющими в центре канал около 2 нм шириной. Эти частицы получили название коннексонов (рис. 154). В зонах щелевого контакта может быть от 10—20 до нескольких тысяч коннексонов в зависимости от функциональных особенностей клеток. Коннексоны были выделены препаративно, они состоят из шести субъединиц коннектина — белка с молекулярной массой около 30 тыс. Объединяясь друг с другом, коннектины образуют цилиндрический агрегат — коннексон, в центре которого располагается канал. Отдельные коннексоны встроены в плазматическую мембрану так, что прободают ее насквозь. Одному коннексону на плазматической мембране клетки точно противостоит коннексон на плазматической мембране соседней клетки, так что каналы двух коннексонов образуют единое целое. Коннексоны играют роль прямых межклеточных каналов, по которым ионы и низкомолекулярные вещества могут диффундировать из клетки в клетку. Коннексоны могут закрываться, изменяя диаметр внутреннего канала, и тем участвовать в регуляции транспорта молекул между клетками.
|
Рис. 154. Схема щелевого соединения 1 — коннексон; 2 — плазматическая мембрана. Стрелка обозначает канал, образованный двумя коннексонами |
При изучении гигантских клеток слюнных желез двукрылых выяснилось, какое функциональное значение имеют щелевые контакты. В такие клетки благодаря их величине легко можно вводить микроэлектроды для того, чтобы изучать электропроводимость их мембран. Оказалось, что если ввести электроды в две соседние клетки, то их плазматические мембраны проявляют низкое электрическое сопротивление, т.е. между клетками идет ток. Более того, выявлено, что при инъекции в одну клетку флуоресцирующего красителя метка быстро обнаруживается в соседних клетках. Используя разные флуорохромы на клетках культуры ткани млекопитающих, обнаружили, что через щелевые контакты могут транспортироваться вещества с молекулярной массой не более 1—1,5 тыс. и размером не более 1,5 нм (у насекомых через щелевой контакт могут проходить вещества с молекулярной массой до 2 тыс.). Среди этих веществ были разные ионы, аминокислоты, нуклеотиды, сахара, витамины, стероиды, гормоны, цАМФ. Ни белки, ни нуклеиновые кислоты через щелевые контакты проходить не могут.
Такая способность щелевых контактов служить местом транспорта низкомолекулярных соединений используется в тех клеточных системах, где нужна быстрая передача электрического импульса (волны возбуждения) от клетки к клетке без участия нервного медиатора. Так, все мышечные клетки миокарда сердца связаны с помощью щелевых контактов (кроме того, клетки там связаны и адгезивными контактами) (см. рис. 147, б). Это создает условие для синхронного сокращения огромного количества клеток. При росте культуры эмбриональных сердечных мышечных клеток (миокардиоцитов) некоторые клетки в пласте начинают независимо друг от друга спонтанно сокращаться с разной частотой, и лишь после образования между ними щелевых контактов они начинают биться синхронно, как единый сокращающийся пласт клеток. Таким же способом обеспечивается совместное сокращение гладкомышечных клеток в стенке матки.
Щелевые контакты могут служить целям метаболической кооперации между клетками, обмениваясь различными молекулами, гормонами, цАМФ или метаболитами. Примером может служить совместное культивирование мутантных по тимидинкиназе клеток с нормальными: при возникновении щелевых контактов между этими типами клеток мутантные клетки через щелевые контакты получали от нормальных клеток тимидинтрифосфат и могли участвовать в синтезе ДНК.
У ранних эмбрионов позвоночных, начиная с восьмиклеточной стадии, большинство клеток связано друг с другом щелевыми контактами. По мере дифференцировки эмбриона щелевые контакты между всеми клетками исчезают и остаются только между группами специализирующихся клеток. Например, при образовании нервной трубки связь клеток этой структуры с остальным эпидермисом прерывается и они разобщаются.
Целостность и функционирование щелевых контактов сильно зависят от уровня ионов Са2+ внутри клетки. В норме концентрация кальция в цитоплазме очень низка. Если Са2+ инъецировать в одну из клеток пласта культуры тканей, то в соседних клетках увеличения уровня Са2+ в цитоплазме не происходит; клетки как бы разобщаются с соседями, перестают проводить электрический ток и красители. Через некоторое время, после того как введенный кальций будет аккумулирован митохондриями, структура и функции щелевых контактов восстанавливаются. Такое свойство очень важно для поддержания целостности и работы всего слоя клеток, так как повреждение одной из них не передается на соседний через щелевые контакты, которые перестают работать как межклеточные диффузионные каналы.
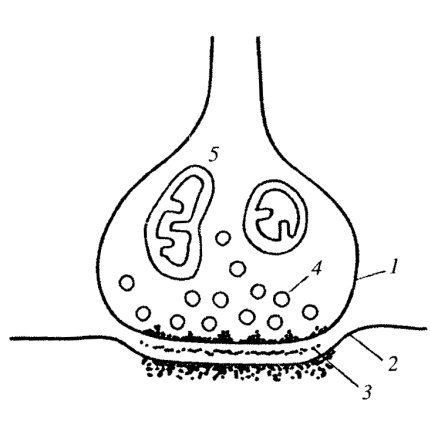
Синаптический контакт (синапсы). Этот тип контактов характерен для нервной ткани и встречается как между двумя нейронами, так и между нейроном и каким-либо иным элементом - рецептором или эффектором (например, нервно-мышечное окончание). Синапсы — участки контактов двух клеток, специализированных для односторонней передачи возбуждения или торможения от одного элемента к другому (рис. 155). В принципе подобного рода функциональная нагрузка, передача импульса, может осуществляться и другими типами контактов (например, щелевым контактом в сердечной мышце), однако в синаптической связи достигается высокая эффективность в реализации нервного импульса. Синапсы образуются на отростках нервных клеток — это терминальные участки дендритов и аксонов. Межнейронные синапсы обычно имеют вид грушевидных расширений - бляшек на конце отростка нервной клетки. Такое терминальное расширение отростка одной из нервных клеток может контактировать и образовывать синаптическую связь как с телом другой нервной клетки, так и с ее отростками. Периферические отростки нервных клеток (аксоны) образуют специфические контакты с клетками-эффекторами или клетками-рецепторами. Следовательно, синапс — это структура, образующаяся между участками двух клеток (так же как и десмосома). Мембраны этих клеток разделены межклеточным пространством - синаптической щелью шириной около 20-30 нм. Часто в просвете этой щели виден тонковолокнистый, перпендикулярно расположенный по отношению к мембранам материал. Мембрана в области синаптического контакта одной клетки называется пресинаптической, мембрана другой клетки, воспринимающей импульс, - постсинаптической. В электронном микроскопе обе мембраны выглядят плотными, толстыми. Около пресинаптической мембраны выявляется огромное количество мелких вакуолей - синаптических пузырьков, заполненных медиаторами. Синаптические пузырьки в момент прохождения нервного импульса выбрасывают свое содержимое в синаптическую щель. Постсинаптическая мембрана часто выглядит толще обычных мембран из-за скопления около нее со стороны цитоплазмы множества тонких фибрилл.
|
Рис. 155. Схема синаптического нервного соединения 1 — пресинаптическая мембрана (мембрана отростка нервной клетки); 2 — постсинаптическая мембрана; 3 — синаптическая щель; 4 — синаптические пузырьки; 5 — митохондрии |
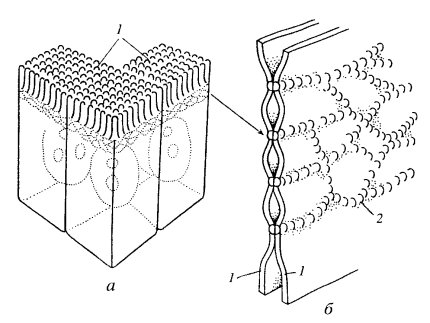
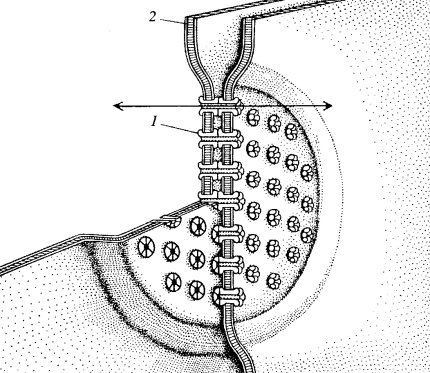
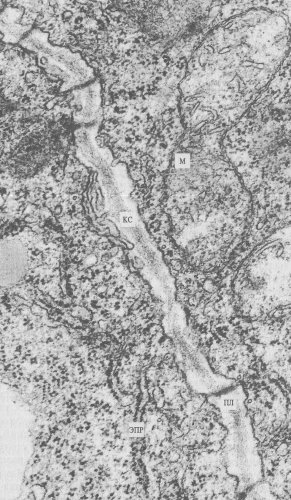
Плазмодесмы. Этот тип межклеточных связей встречается у растений. Плазмодесмы представляют собой тонкие трубчатые цитоплазматические каналы, соединяющие две соседние клетки. Диаметр этих каналов обычно составляет 20—40 нм. Ограничивающая эти каналы мембрана непосредственно переходит в плазматические мембраны соседствующих клеток. Плазмодесмы проходят сквозь клеточную стенку, разделяющую клетки (рис. 156 и 157). Таким образом, у некоторых растительных клеток плазмодесмы соединяют гиалоплазму соседних клеток, поэтому формально здесь нет полного разграничения, отделения тела одной клетки от другой, это скорее представляет собой синцитий: объединение многих клеточных территорий с помощью цитоплазматических мостиков. Внутрь плазмодесм могут проникать мембранные трубчатые элементы, соединяющие цистерны эндоплазматического ретикулума соседних клеток. Образуются плазмодесмы во время деления клетки, когда строится первичная клеточная оболочка. У только что разделившихся клеток число плазмодесм может быть очень велико (до 1000 на клетку), при старении клеток их число падает за счет разрывов при увеличении толщины клеточной стенки.
|
Рис. 156. Плазмодесмы — межклеточные соединения между двумя клетками корневой меристемы лука КС — клеточная стенка; ПЛ — плазмодесмы; ЭПР — эндоплазматический ретикулум; М — митохондрия |
|
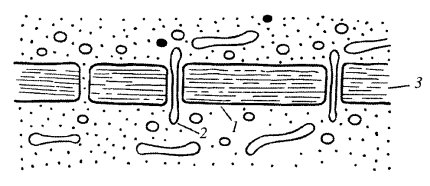
Рис. 157. Схема строения плазмодесмы 1 — плазматическая мембрана; 2 — мембрана десмотубулы; 3 — клеточная стенка |
Функциональная роль плазмодесм очень велика: с их помощью обеспечивается межклеточная циркуляция растворов, содержащих питательные вещества, ионы и другие соединения. По плазмодесмам могут перемещаться липидные капли. Через плазмодесмы происходит заражение клеток растительными вирусами. Однако эксперименты показывают, что свободный транспорт через плазмодесмы ограничивается частицами с массой не более 800 Да.

Клеточная стенка (оболочка) растений
Если выделить любую клетку из организма животного и поместить ее в воду, то через короткое время клетка после набухания лопнет, т.е. она лизируется. Это происходит вследствие того, что через плазматическую мембрану вода поступает в цитоплазму, в зону с более высокой концентрацией солей и органических молекул. При этом увеличивается внутренний объем клетки до тех пор, пока не разорвется плазматическая мембрана. В организме животных этого не происходит, потому что клетки низших и высших животных существуют в окружении жидкостей внутренней среды, концентрация солей и веществ в которой близка к таковой в цитоплазме. Свободноживущие в пресной воде одноклеточные простейшие организмы не лизируются (при отсутствии клеточной стенки) из-за того, что у них постоянно работает клеточный насос, откачивающий воду из цитоплазмы, — сократительная вакуоль.
Если же мы в воду поместим клетки бактерий или растений, то они не будут лизироваться до тех пор, пока цела их клеточная стенка. Воздействием набора различных ферментов эти стенки можно растворить. В этом случае моментально происходят набухание и разрыв (лизис) клеток. Следовательно, в естественных условиях клеточная стенка предотвращает этот гибельный для клетки процесс. Более того, наличие клеточных стенок является одним из главных факторов, регулирующих поступление воды в клетку. Клетки бактерий и растений обитают чаше всего в гипотонической водной среде, они не имеют сократительных (выделительных) вакуолей, чтобы откачать воду, но зато прочная клеточная стенка предохраняет их от чрезвычайного набухания. По мере поступления воды в клетке возникает внутреннее давление — тургор, который препятствует дальнейшему поступлению воды.
Интересно, что у многих низших растений, например у зеленых водорослей, клетки имеют хорошо сформированную клеточную оболочку, но при половом размножении, когда образуются подвижные зооспоры, последние теряют клеточную оболочку и у них появляются пульсирующие вакуоли.
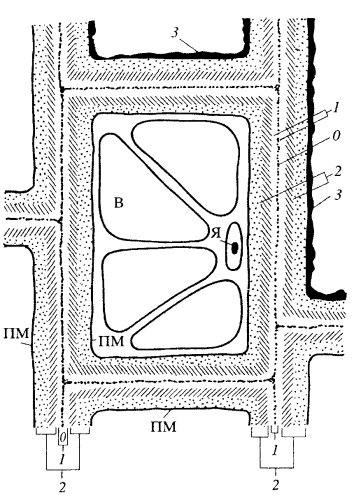
Клеточная стенка растений формируется при участии плазматической мембраны и является экстраклеточным (внеклеточным) многослойным образованием, защищающим поверхность клетки и служащим как бы наружным скелетом растительной клетки (рис. 158). Клеточная стенка растений состоит из двух компонентов: аморфного пластичного гелеобразного матрикса (основы) с высоким содержанием воды и опорной фибриллярной системы. Дополнительные полимерные вещества и соли, часто входящие в состав оболочек, придают им жесткость и делают их несмачиваемыми.
|
Рис. 158. Схема строения клеточной стенки растений 0 — срединная пластинка; 1 — первичная оболочка (два слоя по обе стороны от 0); 2 — слои вторичной оболочки; 3 — третичная оболочка; ПМ — плазматическая мембрана; В — вакуоль; Я — ядро |
В химическом отношении главные компоненты оболочек растений относятся к структурным полисахаридам. В состав матрикса оболочек растений входят гетерогенные группы полисахаридов, растворяющиеся в концентрированных щелочах, гемицеллюлозы и пектиновые вещества. Гемицеллюлозы представляют собой ветвящиеся полимерные цепи, состоящие из различных гексоз (глюкоза, манноза, галактоза и др.), пентоз (ксилоза, арабиноза) и уроновых кислот (глюкуроновая и галактуроновая). Эти компоненты гемицеллюлоз сочетаются между собой в разных количественных отношениях и образуют разнообразные комбинации. Цепи гемицеллюлозных молекул не кристаллизуются и не образуют элементарных фибрилл. Из-за наличия полярных групп уроновых кислот они сильно гидратированы.
Пектиновые вещества — гетерогенная группа, в которую входят разветвленные, сильно гидратированные полимеры, несущие отрицательные заряды из-за множества остатков галактуроновой кислоты. Благодаря свойствам своих компонентов матрикс представляет собой мягкую пластическую массу, укрепленную фибриллами.
Волокнистые компоненты клеточных оболочек растений состоят обычно из целлюлозы — линейного, неветвящегося полимера глюкозы. Молекулярная масса целлюлозы варьирует от 5·104 до 5·105 , что соответствует 300-3000 остаткам глюкозы. Такие линейные молекулы целлюлозы могут соединяться в пучки или волокна. В клеточной оболочке целлюлоза образует фибриллы, которые состоят из субмикроскопических микрофибрилл толщиной до 25 нм, а они в свою очередь состоят из множества параллельно лежащих цепей молекул целлюлозы.
Количественные соотношения целлюлозы к веществам матрикса (гемицеллюлозы) могут быть весьма различными у разных объектов. Свыше 60% сухой массы первичных оболочек составляет их матрикс и около 30% приходится на скелетное вещество — целлюлозу. В сырых клеточных оболочках почти вся вода связана с гемицеллюлозами, поэтому масса основного вещества в набухшем состоянии достигает 80% сырой массы всей оболочки, тогда как содержание волокнистых веществ сводится всего к 12%. В волосках хлопчатника целлюлозный компонент составляет 90%; в древесине на долю целлюлозы приходится 50% от компонентов клеточной стенки.
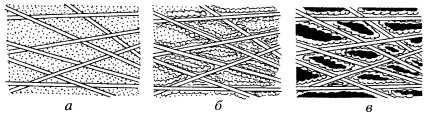
Кроме целлюлозы, гемицеллюлозы и пектинов в состав клеточных оболочек входят дополнительные компоненты, придающие им особые свойства. Так, инкрустация (включение внутрь) оболочек лигнином (полимер кониферилового спирта) приводит к одревеснению клеточных стенок, повышению их прочности (рис. 159). Лигнин замешает в таких оболочках пластические вещества матрикса и играет роль основного вещества, обладающего высокой прочностью. Часто матрикс укреплен минеральными веществами (SiO2, CaCO3 и др.).
|
Рис. 159. Инкрустация клеточной оболочки а — фибриллярный каркас и межфибриллярный матрикс; б — инкрустированная лигнином и утерявшая способность к растяжению оболочка с остатками матрикса; в — последующее инкрустирование фенолами и (или) минеральными веществами, приводящее к повышению твердости оболочки |
На поверхности клеточной оболочки могут скапливаться различные адкрустирующие вещества, например кутин и суберин, приводящие к опробковению клеток. В клетках эпидермиса на поверхности клеточных оболочек откладывается воск, который образует водонепроницаемый слой, препятствующий потере клеткой воды.
Из-за своего пористого, рыхлого строения клеточная стенка растений проницаема в значительной степени для низкомолекулярных соединений, таких как вода, сахара и ионы. Но макромолекулы проникают через целлюлозные оболочки плохо: величина пор в оболочках, позволяющая свободную диффузию веществ, составляет всего лишь 3—5 нм.
Опыты с мечеными соединениями показали, что при росте клеточной оболочки выделение веществ, из которых она строится, происходит по всей поверхности клетки. Аморфные вещества матрикса, гемицеллюлозы и пектины синтезируются в вакуолях аппарата Гольджи и выделяются через плазмалемму путем экзоцитоза. Фибриллы целлюлозы синтезируются специальными ферментами, встроенными в плазмалемму.
Оболочки дифференцированных, зрелых, клеток обычно многослойные, в слоях фибриллы целлюлозы ориентированы по-разному, и количество их также может значительно колебаться. Обычно описывают первичные, вторичные и третичные клеточные оболочки (см. рис. 158). Для того чтобы разобраться в строении и появлении этих оболочек, необходимо познакомиться с тем, как они образуются после деления клеток.
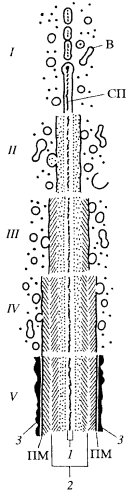
При делении клеток растений после расхождения хромосом в экваториальной плоскости клеток появляется скопление мелких мембранных пузырьков, которые в центральной части клеток начинают сливаться друг с другом (рис. 160). Этот процесс слияния мелких вакуолей происходит от центра клетки к периферии и продолжается до тех пор, пока мембранные пузырьки не сольются между собой и с плазматической мембраной боковой поверхности клетки. Так образуется клеточная пластинка, или фрагмопласт. В центральной части ее располагается аморфное вещество матрикса, которое наполняло сливающиеся пузырьки. Доказано, что эти первичные вакуоли происходят от мембран аппарата Гольджи. В состав первичной клеточной стенки входит также небольшое количество белка (около 10%), богатого гидроксипролином и имеющего множество коротких олигосахаридных цепей, что определяет этот белок как гликопротеид. По периферии клеточной пластинки при наблюдении ее в поляризованном свете обнаруживается заметное двойное лучепреломление, вызванное тем, что в этом месте располагаются ориентированные фибриллы целлюлозы. Таким образом, растущая первичная клеточная стенка состоит уже из трех слоев: центрального — срединная пластинка, состоящая только из аморфного матрикса, и двух периферических — первичная оболочка, содержащая гемицеллюлозу и целлюлозные фибриллы. Если срединная пластинка - это продукт активности исходной клетки, то первичная оболочка образуется за счет выделения гемицеллюлозы и фибрилл целлюлозы двумя новыми клеточными телами. И все дальнейшее увеличение толщины клеточной (вернее, межклеточной) стенки будет происходить за счет активности двух дочерних клеток, которые с противоположных сторон выделяют вещества клеточной оболочки, утолщающейся путем подслаивания все новых и новых пластов. Как и с самого начала, выделение веществ матрикса осуществляется за счет подхода к плазматической мембране пузырьков аппарата Гольджи, слияния их с мембраной и высвобождения их содержимого за пределы цитоплазмы. Здесь же, вне клетки, на ее плазматической мембране идет синтез и полимеризация целлюлозных фибрилл. Так постепенно образуется вторичная клеточная оболочка. С достаточной точностью определить и суметь отличить первичную оболочку от вторичной трудно, так как они соединены между собой несколькими промежуточными слоями.
|
Рис. 160. Схема роста клеточной оболочки от её закладки при делении клетки (I) до полного созревания (V) 1 — первичная оболочка; 2 — слои вторичной оболочки; 3 — третичная оболочка; В — вакуоли; СП — срединная пластинка; ПМ — плазматические мембраны двух соседних клеток |
Основную массу закончившей свое формирование клеточной стенки составляет вторичная оболочка. Она придает клетке ее окончательную форму. После разделения клетки на две дочерние происходит рост новых клеток, увеличение их объема и изменение формы; клетки часто вытягиваются в длину. Одновременно с этим идут наращивание толщины клеточной оболочки и перестройка ее внутренней структуры.
При образовании первичной клеточной оболочки в ее составе еще мало целлюлозных фибрилл, и они располагаются более или менее перпендикулярно будущей продольной оси клетки. Позже, в период растяжения (удлинения клетки за счет роста вакуолей в цитоплазме) ориентация этих поперечно-направленных фибрилл подвергается пассивным изменениям: фибриллы начинают размещаться под прямым углом друг к другу и в конечном счете оказываются вытянутыми более или менее параллельно продольной оси клетки. Постоянно идет процесс: в старых слоях (ближе к центру оболочки) фибриллы подвергаются пассивным сдвигам, а отложение новых фибрилл во внутренних слоях (ближайших к мембране клетки) продолжается в соответствии с исходным планом конструкции оболочки. Этот процесс создает возможность скольжения фибрилл относительно друг друга, а перестройка арматуры клеточной оболочки возможна из-за студенистого состояния компонентов ее матрикса. В дальнейшем при замещении в матриксе гемицеллюлозы на лигнин подвижность фибрилл резко снижается, оболочка становится плотной, происходит одревеснение.
Часто под вторичной оболочкой обнаруживают третичную оболочку, которую можно рассматривать как засохший остаток дегенерировавшего слоя собственно цитоплазмы.
Следует отметить, что при делении клеток растений формированию первичной оболочки не во всех случаях предшествует образование клеточной пластинки. Так, у зеленой водоросли спирогиры новые поперечные перегородки возникают путем образования на боковых стенках исходной клетки выступов, которые, постепенно разрастаясь к центру клетки, смыкаются и делят клетку надвое.
Как уже говорилось, если в водной гипотонической среде лишить клетку ее оболочки, то произойдет лизис, разрыв клетки. Оказалось, что, подбирая соответствующие концентрации солей и сахаров, можно уравнять осмотическое давление снаружи и внутри клеток, лишенных своих оболочек. При этом такие протопласты приобретают шаровидную форму (сферопласты). Если в среде, где находятся протопласты, будет достаточное количество питательных веществ и солей (среди них необходим Са2+), то клетки снова восстанавливают, регенерируют свою клеточную оболочку. Более того, они способны в присутствии гормонов (ауксинов) делиться и создавать клеточные колонии, которые могут дать начало для роста целого растения, от которого была взята клетка.
Главный волокнистый компонент клеточной стенки больших групп грибов (базибиомицеты, аскомицеты, зигомицеты) — хитин; это — полисахарид, в котором основным сахаридом является N-ацетилглюкозамин. В состав клеточной стенки грибов, кроме хитина, могут входить вещества матрикса, гликопротеиды и различные белки, синтезированные в цитоплазме и выделенные клеткой наружу.

Клеточные оболочки бактерий
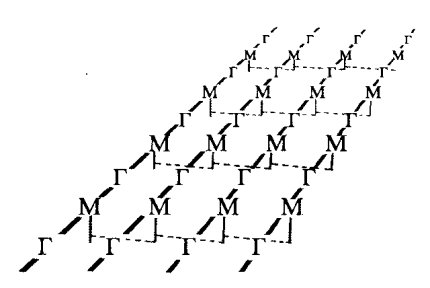
Опорным каркасом клеточной стенки бактерий и синезеленых водорослей также служит в значительной степени однородный полимер — пептидогликан, или муреин. Жесткий каркас, окружающий бактериальную клетку, представляет собой одну гигантскую мешковидную молекулу сложного полисахарида — пептида. Каркас этот называют муреиновым мешком. Основа структуры муреинового мешка — сеть параллельных полисахаридных цепей, построенных из чередующихся дисахаридов (ацетилглюкозамин, соединенный с ацетилмурамовой кислотой), связанных многочисленными пептидными поперечными связями (рис. 161). Длина цепочек может быть огромной — до нескольких сотен дисахаридных блоков. Основу пептидной части муреина составляют тетрапептиды, образованные различными аминокислотами.
|
Рис. 161. Муреиновая сеть N-ацетилмурамовая кислота (М) и N-ацетилглюкозамин (Г) соединены между собой пептидными мостиками |
Бактериальная стенка может составлять до 20-30% от сухой массы бактерии. Это связано с тем, что в ее состав кроме многослойного муреинового каркаса входит большое количество дополнительных компонентов, как и в матриксе стенки растений. У грамположительных бактерий (при окраске по Граму — окраска кристаллическим фиолетовым, обработка иодом, отмывка спиртом — бактерии по-разному воспринимают краситель: грамположительные остаются окрашенными после обработки спиртом, грамотрицательные обесцвечиваются) сопутствующими компонентами служат полимерные вещества, сложным образом вплетенные в муреиновую сеть. К ним относятся тейхоевые кислоты, полисахариды, полипептиды и белки. Клеточная стенка грамположительных бактерий обладает большой жесткостью, ее муреиновая сеть многослойна.
Стенки грамотрицательных бактерий содержат однослойную муреиновую сеть, составляющую 12% сухой массы стенки. Сопутствующие компоненты составляют до 80% сухой массы. Это липопротеиды, сложные липополисахариды. Они образуют сложную наружную липопротеиновую мембрану. Следовательно, периферия грамотрицательных бактерий содержит наружную мембрану, затем однослойную муреиновую сеть, ниже нее расположена плазматическая мембрана (рис. 162). Наружная мембрана обеспечивает структурную целостность клетки, служит барьером, ограничивающим свободный доступ разных веществ к плазматической мембране. На ней также могут располагаться рецепторы для бактериофагов. Она содержит белки-порины, которые участвуют в переносе многих низкомолекулярных веществ. Молекулы порина образуют тримеры, проходящие сквозь толщу мембраны. Одна из функций этих белков — формирование в мембране гидрофильных пор, через которые происходит диффузия молекул массой не более 900 Да. Через поры свободно проходят сахара, аминокислоты, небольшие олигосахариды и пептиды. Поры образованы разными поринами, обладают разной проницаемостью.
|
Рис. 162. Схема строения клеточной стенки грамположительных (а) и грамотрицательных (б) бактерий 1 — плазмалемма; 2 — муреиновый слой; 3 — липопротеидный слой; 4 — периплазматическое пространство |
Между внешней липопротеидной мембраной бактериальной стенки и плазматической мембраной лежит периплазматическое пространство, или периплазма. Ее толщина обычно составляет около 10 нм, она содержит тонкий (1—3 нм) муреиновый слой и раствор, содержащий специфические белки двух типов: гидролитические ферменты и транспортные белки. Из-за наличия гидролаз иногда периплазму рассматривают как аналог лизосомного компартмента эукариот. Периплазматические транспортные белки связывают и переносят от внешней мембраны к плазмалемме сахара, аминокислоты и др.
Предшественники стенок бактерий синтезируются внутри клетки, сборка стенок происходит снаружи от плазматической мембраны.
Под действием фермента лизоцима можно разорвать муреиновый каркас и растворить бактериальную стенку. В гипотонических условиях клетки при этом разрушаются, как разрушаются голые клетки животных и растений; в изотонических условиях образуются шаровидные протопласты, которые способны снова вырабатывать свою клеточную стенку.
Интересно, что протопласты бактерий нечувствительны к действию бактериофагов — вирусов, паразитирующих на бактериях. Следовательно, компоненты бактериальной стенки обладают антигенной специфичностью по отношению к этим вирусам.

Величко В.В. © Copyright 2008.![]()
![]()