О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыЦЕНТРАЛЬНАЯ ДОГМА МОЛЕКУЛЯРНОЙ БИОЛОГИИ
ХРОМОНЕМНЫЙ (ЧЕТВЕРТЫЙ) УРОВЕНЬ УПАКОВКИ ХРОМАТИНА
НЕРИБОСОМНЫЕ ПРОДУКТЫ КЛЕТОЧНОГО ЯДРА
ЯДЕРНАЯ ОБОЛОЧКА

Структура, ограничивающая параметр клеточного ядра, — ядерная оболочка, характерна для эукариотических клеток. Она разделяет два внутриклеточных компартмента друг от друга — цитоплазму от ядра. Значение такого разделения структур в пространстве очень важно: это приводит к обособлению процессов синтеза белка и процессов синтеза нуклеиновых кислот, что создает дополнительные, по сравнению с прокариотами, возможности для регуляции генной активности и ее реализации в виде синтеза специфических белков. Активная регуляция транспорта из цитоплазмы в ядро и из ядра в цитоплазму через специальные комплексы пор создает систему избирательного транспорта веществ, делая ядерную оболочку «генными воротами» со специальными «привратниками» (контрольными пунктами), регулирующими потоки ядерного импорта и экспорта. Кроме того, как уже упоминалось, ядерная оболочка играет большую роль в организации трехмерной структуры интерфазного ядра, элементы ядерной оболочки являются частью ядерного белкового матрикса.
Ядерная оболочка состоит из двух мембран — внешней и внутренней, между которыми располагается перинуклеарное пространство (рис. 106). Внутренняя мембрана ядерной оболочки структурно связана с ламиной — фиброзным периферическим слоем ядерного белкового матрикса. В общем виде ядерная оболочка может быть представлена как двухслойный мешок, отделяющий содержимое ядра от цитоплазмы. Однако ядерная оболочка имеет характерную особенность, отличающую ее от других двухмембранных структур клетки (митохондрий и пластид). Это наличие особых ядерных пор, которые образуются за счет многочисленных зон слияния двух ядерных мембран и представляют собой как бы округлые, сквозные перфорации всей ядерной оболочки.
|
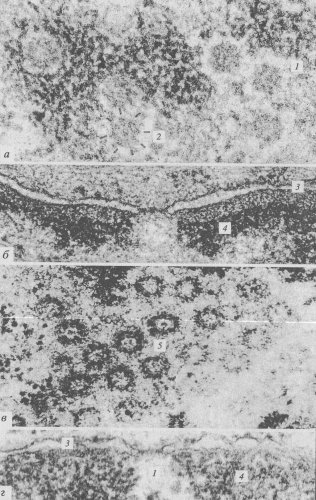
Рис. 106. Участок периферии ядра 1 — внешняя мембрана ядерной оболочки; 2 — перинуклеарное пространство; 3 — внутренняя мембрана ядерной оболочки; 4 — ядерные поры; 5 — ламины; 6 — хроматин; 7 — мембраны цитоплазмы |

Компоненты ядерной оболочки
Внешняя мембрана ядерной оболочки, непосредственно контактирующая с цитоплазмой клетки, имеет ряд структурных особенностей, позволяющих отнести ее к собственно мембранной системе эндоплазматического ретикулума (ЭПР). Так, на внешней ядерной мембране обычно располагается большое количество рибосом, как и на мембранах эргастоплазмы. Существуют многочисленные наблюдения о непосредственном переходе внешней ядерной мембраны в систему каналов эндоплазматического ретикулума, что особенно подчеркивает структурную идентичность этих мембран (см. рис. 106).
Так, у клеток, бедных эндоплазматическим ретикулумом, внешняя ядерная мембрана может представлять собой «минимальный» объем эндоплазматического ретикулума, который может участвовать в синтезе белкового и липидного компонентов мембран. Описаны случаи, когда от внешней ядерной мембраны отщепляются мембранные вакуоли, направляющиеся в проксимальный отдел аппарата Гольджи. Состав липидов и белков внешней ядерной мембраны очень схож с таковым ретикулума. Возможно, именно это определяет их общие биохимические функции, что особенно подчеркивается наличием рибосом на поверхности мембран, обращенной в гиалоплазму. Эти рибосомы синтезируют как мембранные, так и секретируемые белки, которые могут транспортироваться в перинуклеарное пространство, а оттуда в полости цистерн ЭПР. Например, при стимуляции образования γ-глобулинов в плазмацитах первые продукты клеточной активности локализуются в перинуклеарном пространстве, а потом начинают появляться в полостях ЭПР. У большинства животных и растительных клеток внешняя мембрана ядерной оболочки не представляет собой идеально ровную поверхность, она может образовывать различной величины выпячивания или выросты в сторону цитоплазмы.
Внутренняя мембрана ядерной оболочки рибосом на своей поверхности не имеет, но связана с фиброзным слоем — ядерной ламиной (lamina nucleum limitans), которая, в свою очередь, заякоривает хроматин на ядерной оболочке. Связь хроматина с внутренней мембраной оболочки является ее характерной особенностью, хотя существуют примеры, когда эти связи нарушаются при сохранении целостности ядерной оболочки. Так, в ооцитах амфибий на стадии диплотены все хромосомы собираются в центре ядра и полностью теряют связь с ядерной оболочкой. В то же время при делении клеток с так называемым закрытым типом митоза большая часть внутренней ядерной мембраны теряет связь с хроматином.
О специфичности белков ламины уже говорилось в разделе «Ядерный белковый матрикс», здесь же необходимо еще раз подчеркнуть, что эти фибриллярные белки не образуют неизменную структуру. Фиброзный слой ламины все время перестраивается, особенно в связи с ростом поверхности ядра, во время клеточного цикла. Характерные для внутренней ядерной мембраны белки — ламины А, С и В — относятся к фибриллярным белкам V типа промежуточных филаментов (см. далее), их фибриллярные мономеры могут образовывать димеры и тетрамеры, а последние образуют фибриллы толщиной около 10 нм. Со стороны кариоплазмы под внутренней ядерной мембраной такие фибриллы образуют ортогональные структуры, чередующиеся с рыхло расположенной сетью этих же фибрилл.
Белки ламины с мембраной связаны двояким образом. Так, ламин В после синтеза модифицируется добавлением гидрофобной изопентильной группы вблизи С-конца. Эта липофильная группа встраивается в слой мембраны и как бы заякоривает ламину на мембране. Кроме того, целый ряд интегральных белков внутренней ядерной мембраны (LBR, LAR, эмерин и др.) также закрепляет ламины посредством дополнительных белков, входящих в состав этого фиброзного слоя. Эти же белки участвуют в связывании ядерной мембраны с хроматином.
Наиболее характерной и бросающейся в глаза структурой в составе ядерной оболочки является ядерная пора. Поры в оболочке образуются за счет слияния двух ядерных мембран в виде округлых сквозных отверстий, или перфораций, с диаметром около 100 нм. При альдегидной фиксации или при использовании метода замораживания и скалывания в электронном микроскопе видно, что округлое сквозное отверстие в ядерной оболочке заполнено сложно организованными глобулярными и фибриллярными структурами (рис. 107). Совокупность мембранных перфораций и этих структур называют комплексом пор ядра. Тем самым подчеркивается, что ядерная пора не просто сквозная дыра в ядерной оболочке, через которую непосредственно вещества ядра и цитоплазмы могут сообщаться. Компоненты комплекса пор имеют белковую природу.
|
Рис. 107. Микрофотография поверхности клеточного ядра (метод замораживания—скалывания), полученная с помощью электронного микроскопа 1 — участки комплексов ядерных пор |
Ядерный пóровый комплекс (ЯПК, или NPC - nuclear pore complex) представляет собой супрамолекулярную структуру с молекулярной массой более 125·106 Да, состоящую из более 1000 белков, масса которых в 30 раз больше, чем рибосома. Белки ЯПК носят название нуклеопоринов. Насчитывается 50-100 видов этих структур; они собраны примерно в 12 субкомплексов.
В последнее время удалось получить отчетливые изображения ЯПК в электронном микроскопе, что дает возможность понять их структурную организацию. Внешний диаметр порового комплекса составляет около 100 нм, а высота - 75 нм. В целом он представляет собой цилиндрическую фигуру с признаками октогональной симметрии. Несмотря на впечатляющие изображения выделенных ЯПК, разные авторы дают разные схемы строения этого сложного комплекса, обладающего симметрией восьмого порядка.
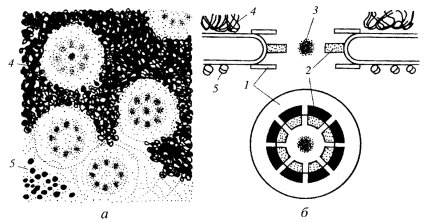
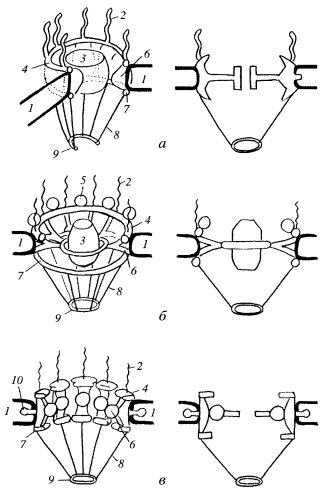
Если посмотреть на ЯПК в плане на ультратонком срезе, то бросается в глаза, что его периферия представлена восемью глобулами (рис. 108 и 109). На выделенных же ЯПК в первую очередь видны кольчатые структуры. От периферических компонентов ЯПК в сторону цитоплазмы простираются фибриллярные выросты. Со стороны ядра фибриллярные выросты образуют корзинкоподобную структуру, связанную терминальным кольцом. В большинстве моделей центр цилиндрической фигуры ЯПК содержит «пробку» (центральную гранулу, или транспортер). По одной из моделей (рис. 110), цитоплазматические филаменты отходят от цитоплазматического кольца, состоящего из восьми субъединиц. Между ним и внешней ядерной мембраной располагается тонкое кольцо, а затем звездчатое кольцо. Цитоплазматическое кольцо связано внутренними филаментами с транспортером, который находится в центре и заполняет пространство между внешней и внутренней ядерной мембраной. Сходная структура находится на внутренней мембране: нуклеоплазматическое кольцо поддерживает филаменты «корзины». Другие варианты моделей показаны на рис. 110.
|
Рис. 108. Комплексы ядерных пор (КЯП) на ультратонких срезах а, в — вид в плане; б, г — поперечные срезы. 1 — КЯП; 2 — восемь периферических субъединиц (глобул); 3 — ядерная оболочка; 4 — хроматин; 5 — центральная гранула («транспортер») |
|
Рис. 109. Общая схема строения ядерных пор а — внешний вид ядерных пор в ядре ооцитов; 6 — схема строения ядерной поры. 1 — кольцо; 2 — спицы; 3 — центральная гранула; 4 — хроматин; 5 — рибосомы |
|
Рис. 110. Различные модели строения комплекса ядерной поры а — по Lodish и соавт. (2000); б — по Каrр (1999); в — по Alberts и соавт. (1994). Слева — трехмерные модели, справа — пора в разрезе. 1 — ядерная оболочка; 2 — цитоплазматические филамепты; 3 — центральная гранула («транспортер»); 4 — цитоплазматическос кольцо; 5 — цитоплазматическая субъединица; 6 — спица; 7 — ядерное кольцо; 8 — фибриллы корзинки; 9 — терминальное кольцо; 10 — аннулярные субъединицы |
Весь ЯПК закрепляется интегральными белками — гликопротеидами gp 210 и РОМ 121 — в стенке мембранной перфорации. По сложности организации и, главное, по функциональной значимости комплекс ядерной поры можно было бы отнести к органеллам клетки, так как их роль заключается в контроле за ядерно-цитоплазменными связями.
Размер ядерных пор и их структура стандартны не только для данной клетки, но и для всех клеток данного организма, более того — для всех эукариот. Число ядерных пор (табл. 13) зависит от метаболической активности клеток: чем выше синтетические процессы в клетках, тем больше пор на единицу поверхности клеточного ядра. Так, у эритробластов (клетки-предшественники ядерных эритроцитов) низших позвоночных животных во время интенсивного синтеза и накопления гемоглобина обнаруживается в ядре около 30 ядерных пор на 1 мкм2. После того как эти процессы заканчиваются, в ядрах зрелых клеток — эритроцитов, прекращаются синтезы ДНК и РНК и количество пор падает до пяти на 1 мкм2. В ядерных оболочках полностью зрелых сперматозоидов поры не обнаруживаются, так же как у микронуклеусов некоторых инфузорий. Количество пор может изменяться в течение клеточного цикла. Первое возрастание числа пор наблюдается при реконструкции и росте ядер после митоза, второй этап увеличения числа пор происходит во время синтеза ДНК.
Таблица 13 |
Количество ядерных пор в различных объектах |
|
По поверхности ядра поры располагаются более или менее равномерно, но их число резко падает в местах ассоциации с ядерной оболочкой участков гетерохроматина, ядрышкового организатора и теломерных участков.
Поровые комплексы могут встречаться и в других мембранных компонентах клетки, но гораздо реже, чем в ядерной оболочке. Иногда поровые комплексы видны в составе мембран гранулярного эндоплазматического ретикулума. Они обнаруживаются в составе окончатых мембран цитоплазмы, которые представляют собой тесно расположенные пачки замкнутых плоских мембранных мешков, сплошь пронизанных поровыми комплексами, имеющими такую же структуру, как и поры в ядерной оболочке.
Интересные данные были получены при морфометрическом изучении поровых комплексов в ядрах и окончатых мембранах бластодермы эмбрионов дрозофилы. Оказалось, что при переходе от синцитиальной к целлюлярной стадии количество пор в оболочках ядер остается неизменным, а количество пор в окончатых пластинках вырастает примерно в 10 раз. В дальнейшем окончатые мембраны полностью исчезают. На основании этого было сделано предположение, что на ранней стадии развития в бластодерме дрозофилы происходит «суперпродукция» поровых комплексов (или их компонентов), избыток которых «встраивается» в окончатые мембраны, т.е. макромолекулярный ансамбль, составляющий комплекс ядерных пор, способен к автономной самосборке и к последующему встраиванию в различные мембранные системы.
|
Поровые комплексы в ядерной оболочке дрожжевой клетки |

Роль ядерной оболочки в ядерно-цитоплазматическом обмене
После открытия ядерной оболочки и описания ее строения пришли к заключению, что ядерная оболочка может служить регулятором в ядерно-цитоплазматическом обмене, главная роль в этих процессах отводилась ядерным порам. Обмен продуктами между ядром и цитоплазмой в самом деле очень велик: все ядерные белки поступают в ядро из цитоплазмы и все формы РНК выводятся из ядер. И в этом процессе комплекс поры выступает как супрамолекулярный комплекс, выполняющий роль не только транслокатора — механизма переноса, но и роль сортировщика, узнающего и отбирающего специальным образом переносимые молекулы.
В процессе ядерно-цитоплазматического транспорта ядерные поры функционируют как некоторое молекулярное сито, пропуская частицы определенного размера пассивно, по градиенту концентрации. Так, ионы, сахара, нуклеотиды, АТФ и гормоны свободно поступают в ядра. В то же время ядерные поры осуществляют избирательный транспорт.
Через ядерную оболочку беспрепятственно в обе стороны происходит пассивный транспорт высокомолекулярных соединений, имеющих массу не более 5·103 Да. Для определения размеров частиц, могущих пройти сквозь пору, используются гранулы декстрана или коллоидного золота, которые путем микроинъекции вводятся в цитоплазму живой клетки. Обнаружено, что максимальный размер частиц, способных транспортироваться в ядро, составляет 8,5—10 нм. При этом сначала частицы собираются в зоне поровых комплексов, а затем оказываются в ядре. Неядерные белки с массой больше 20 000—40 000 Да проникают в ядро медленнее, если вообще проникают. Так, инъецированные белки с массой 17 кДа могут проникнуть к ядро довольно быстро, за 2—3 мин, белки с массой 40 кДа — за 30 мин, белки с массой 60 кДа вообще не проникают в ядра. Считается, что белки с гидродинамическим радиусом больше 3,5 нм (что соответствует глобулярному белку с массой 65 кДа) не могут просто механически проходить через ядерную пору. В этих случаях ядерная пора выступает в качестве реального молекулярного сита.
Но дело осложняется тем, что многие белки как поступают в ядро, так и выходят из него против градиента концентраций. Так, концентрация гистонов в ядре значительно выше, чем в цитоплазме. Но несмотря на это, во время синтеза ДНК происходит транспорт огромного количества (106 молекул каждые три минуты, или по 100—500 молекул через одну пору за 1 мин) гистонов из цитоплазмы в ядро. В то же время через ядерные поры реально могут проходить некоторые белки и даже макромолекулярные комплексы с массой значительно большей, чем 60 кДа.
Через ядерные поры из цитоплазмы в ядро транспортируются крупные молекулы белков, например белок нуклеоплазмин — пентамер с молекулярной массой 125 кДа. Из ядра через поры выходят в цитоплазму субъединицы рибосом и другие рибонуклеопротеиды, меньшие из которых могут иметь массу 250 кДа. Эти данные показывают, что комплексы ядерных пор не представляют собой просто механические сита, которые ограничивают транспорт молекул в зависимости от их размеров.
Работы последнего времени показывают, что многие ядерные белки проходят через ядерные поры с помощью специальных механизмов, включающих узнавание и связывание крупных ядерных белков, а затем только их транслокацию, перенос через поры. Было найдено, что белки, транспортируемые в ядро, имеют определенные последовательности аминокислот — последовательности ядерной локализации (NLS — nuclear localization sequences), которые узнаются рецепторами ядерных пор. Такие NLS характерны для кариофильных белков, т.е. для белков ядерной локализации, которые синтезируются на рибосомах в цитоплазме, а затем транспортируются в ядро.

Импорт кариофильных белков
Впервые аминокислотные последовательности ядерной локализации были обнаружены на С-конце субъединиц молекулы нуклеоплазмина (ядерный белок, принимающий участие в структуризации хроматина). Эти эксперименты были проведены на бесклеточной системе, когда выделенные ядра помещали в цитоплазматический экстракт ооцитов ксенопуса, куда добавляли нативные или измененные молекулы нуклеоплазмина. Это — крупный белок (молекулярная масса 125 кДа), состоящий из пяти субъединиц, каждая из которых обладает глобулярной и фибриллярной С-концевой частью. Если удалить путем протеолиза примерно 50 аминокислот с С-конца, то ни пентамер, ни мономеры в ядро не попадают, в то время как отщепленные фибриллярные участки через поры проходят свободно, так как содержат NLS-участок.
Более того, при смешивании неядерных белков с этими NLS-фрагментами такие комплексы способны транспортироваться в ядро. Даже крупные частицы декстрана (20 нм), неспособные проникать в ядро, при связывании с ними NLS-последовательностей нуклеоплазмина транспортировались из цитоплазматического экстракта в ядро.
Подробно строение NLS изучено у белка Т-антигена вируса SV40. Кариофильный сигнал состоял из последовательности: Pro—Lys—128Lys—Lys—Arg—Lys—Val. Одна лишь аминокислотная замена (128Lys на Thr или Asp) полностью лишают этот фрагмент кариофильных свойств. Оказалось, что можно создавать химерные белки с этим аминокислотным доменом, что позволяет необычные для ядер белки (альбумин плазмы, иммуноглобулин G и даже ферритин с молекулярной массой 465 кДа) транспортировать через ядерные поры.
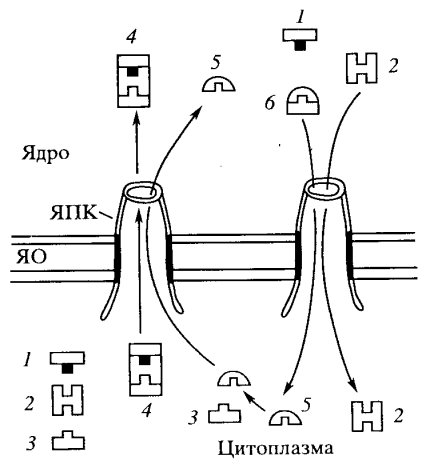
Показано, что белок с NLS проходит в ядро в несколько этапов (рис. 111). Импорт начинается с того, что NLS-белок связывается с гетеродимером рецептора NLS, с белками импортинами α и β, локализованными в цитоплазме. Возникший белковый комплекс (импортируемый белок с NLS, связанный с импортинами α и β подходит к внешней ядерной мембране и закрепляется на цитоплазматических филаментах порового комплекса. Затем этот комплекс входит в ядерную пору и проходит через «транспортер». Считается, что транспортер состоит из множества извитых белковых филаментов, обогащенных аланином и глицином (FG-филаменты), представляющих собой барьер для транспорта некариофильных белков. Комплекс, имеющий NLS, как бы разрыхляет эту сеть и проходит через канал транспортера. После перехода комплекса в нуклеоплазму импортин β связывается с белком RAN, представляющим собой малую GTP-азу, что приводит к распаду комплекса. Импортируемый белок освобождается и остается в ядре, импортин α возвращается в цитоплазму, так же как и импортин β, но в связи с RAN—GDP, где последние также диссоциируют. Тем самым только белок с NLS остается в составе ядра (см. рис. 111).
|
Рис. 111. Схема импорта цитоплазматических белков в ядро ЯПК — комплекс ядерной поры; ЯО — ядерная оболочка. 1 — импортируемый белок с NLS; 2 — импортин α; 3 — импортин β; 4 — импортируемый комплекс; 5 — белок RAN; 6 — комплекс RAN - импортин Р |

Экспорт из ядра в цитоплазму
Из ядра в цитоплазму также существует поток как белков, так и ядерных транскриптов в виде рибонуклеопротеидов. В принципе этот экспорт сходен с процессом импорта кариофильных белков. Обнаружено, что гликопротеидные молекулы, связывающие лиганды, локализуются в месте поровых комплексов и со стороны ядра. Одна и та же пора может принимать участие как в импорте, так и в экспорте макромолекул. В пользу этого говорит то, что частички коллоидного золота, связанного с нуклеоплазмином, сорбируются на ядерной поре со стороны цитоплазмы одновременно с сорбцией частичек, связанных с РНК и инъецированных в ядро ооцитов. Подобные эксперименты показали, что многие РНК (тРНК, 5S РНК, поли-У и поли-А), связанные с коллоидным золотом, аккумулируются в зоне ядерных пор, а затем переносятся в цитоплазму. Более того, РНК способствует переносу через ядерную пору крупных частиц золота размером до 20 нм. Обратного переноса не происходит: аналогичные частички, инъецированные в цитоплазму ооцита, в ядро не проникают.
Что касается естественных видов РНП, то комплексы ядерных пор также должны узнавать специфический сигнал на экспорт. Белковые компоненты РНП несут аминокислотные последовательности - сигналы ядерного экспорта (NES — nuclear export sequences), которые дают возможность различным РНП проходить через ядерную оболочку в цитоплазму.
В этом случае также образуется сложный комплекс, состоящий из переносимого белка с NES-последовательностью (связанного с РНК или свободного), ассоциированного с белком экспортаном 1, который в свою очередь связан с белком RAN—GTP. Этот комплекс проходит через центральный канал, создаваемый транспортером, в цитоплазму, где и диссоциирует. При этом освобождается белок с NES-участком (или РНП), который остается в цитоплазме. Экспортин 1 и RAN после гидролиза GTP снова возвращаются в ядро (рис. 112).
|
Рис. 112. Схема экспорта ядерных белков в цитоплазму ЯПК — комплекс ядерной поры; ЯО — ядерная оболочка. 1 — экспортируемый белок с NES; 2 — экспортин; 3 — белок RAN; 4 — экспортируемый комплекс |
В процессе экспорта РНП ядерная пора контролирует не только белковый компонент. Ядерные поры узнают и не экспортируют короткие (100 нуклеотидов) тРНК, если в их структуре есть хоть одна замена. Незрелые формы иРНК, имеющие интронные участки, не транспортируются. Вообще в цитоплазме не обнаруживаются незрелые РНК. Вероятно, для экспорта некоторых РНК необходима их связь с особыми белками.
Мало изучен вопрос о транспорте в цитоплазму крупных РНП-комплексов, таких как субъединицы рибосом, информосомы и малые ядерные РНП. Возможно, все они под действием каких-то факторов разворачиваются, меняют свою конформацию и проходят через поровый комплекс. В пользу этого говорит наличие гантелевидных РНК-содержащих частиц в просвете пор ядер гигантских слюнных желез насекомых. Считается, что эта картина отражает момент выхода из ядер РНП-частиц диаметром 60 нм, относимых к информоферам. Интересно, что состав белков в цитоплазматических информационных РНП иной, это может говорить о том, что в зоне поровых комплексов происходит «переодевание» информационных РНК и осуществляется связь их с иными белками.

Динамика ядерной оболочки в митозе
Большей частью, но не у всех видов (исключение составляют амебы, эвгленовые, инфузории, динофлагелляты, многие водоросли, некоторые грибы), ядерная оболочка разрушается при митозе и снова возникает после деления клеток. Это так называемый открытый тип митоза (рис. 113). При этом в профазе по мере конденсации хромосом ядерная оболочка теряет с ними связь, а затем в ней появляются разрывы. Она приобретает вид плоских мембранных вакуолей — цистерн. В это время ядерные поры еще видны. Позднее они исчезают. Во время митоза комплекс ядерной поры с мол. массой 120 кДа разбирается на субкомплексы с мол. массой примерно по 1 кДа. Разборка пор начинается с фосфорилирования ряда нуклеопоринов митотической сdс2/циклин В-киназой.
|
Рис. 113. Поведение ядерной оболочки при митозе животной клетки (по: 1 — интерфаза; 2, 3 — профаза; 4 — промстафаза; 5 — метафаза; 6 — анафаза; 7 — телофаза; 8 — реконструкция дочерних ядер. Хромосомы в профазе теряют контакт с ядерной оболочкой и в конце анафазы вступают в объединение с мембранами цитоплазмы |
Ядерная оболочка превращается в скопление мелких мембранных пузырьков, окружающих зону бывшего интерфазного ядра. Такие пузырьки морфологически нельзя отличить от других мелких вакуолей в цитоплазме, они, вероятно, сливаются с вакуолями эндоплазматического ретикулума. В метафазе мембранные элементы цитоплазмы оттесняются к периферическим зонам клеток микротрубочками веретена деления.
В конце анафазы, когда прекращается движение хромосом к противоположным полюсам клетки, мембранные пузырьки цитоплазмы, в первую очередь мембраны гранулярного эндоплазматического ретикулума, начинают контактировать с поверхностью хромосом. Эти контакты происходят сначала в небольшом числе точек, но затем начинаются перестройка и рост этих первичных зачатков ядерной оболочки. Они из мелких пузырьков превращаются в плоские вакуоли, которые растут в ширину и обволакивают поверхность деконденсирующихся хромосом. Участки таких растущих плоских мембранных мешков сливаются, замыкая и отгораживая содержимое нового интерфазного ядра. Интересно, что ядерные поры появляются на самых ранних этапах реконструкции ядерной оболочки, когда двойные мембранные цистерны еще не сомкнулись и фактически ничего не разделяют.
При реконструкции ядерной оболочки происходит сборка ядерных пор. Она начинается с образования ямки при слиянии внешней и внутренней ядерной мембраны, которая затем превращается в отверстие. В этом процессе принимают участие интегральные белки gp 210 и РОМ 121, которые впоследствии будут закреплять ЯПК на мембранах. Затем появляются внутренние структуры ЯПК: комплекс кольца, спиц, добавление звездчатого кольца и других структур и, наконец, филаментов.
У некоторых низших организмов в случае закрытого митоза ядерная оболочка не исчезает, она в зоне ядерной перетяжки замыкается, что приводит к образованию двух новых ядер. Здесь участие ядерной оболочки в делении клетки заключается в том, что на ней закреплены хромосомы, и она, по-видимому, принимает участие в индукции образования микротрубочек, необходимых при делении клеток.
Вероятно, для реконструкции ядерной оболочки необходимым условием является деконденсация хромосом. Показано, что если вызвать преждевременную деконденсацию метафазных хромосом, то они очень быстро контактируют с мембранными пузырьками и каждая одевается своей ядерной оболочкой, вследствие чего в клетке возникает множество так называемых микроядер, каждое их которых возникло из одной хромосомы.
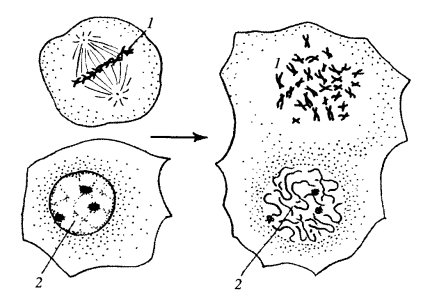
В то же время можно экспериментально вызвать разборку ядерной оболочки у интерфазного ядра. Это происходит при слиянии в культуре ткани двух клеток на разных стадиях клеточного цикла: получается так называемый гетерокарион, где одно из ядер будет находиться в интерфазе, а другое — в виде митотических хромосом в метафазе. В этом случае в интерфазном ядре начинает конденсироваться хроматин, образуются преждевременно конденсированные хромосомы, а ядерная оболочка исчезнет так же, как во время нормального митоза (рис. 114). Эти данные говорят о том, что в цитоплазме митотической клетки существуют какие-то факторы, вызывающие как конденсацию хромосом, так и параллельный этому процесс распада ядерной оболочки.
|
Рис. 114. Преждевременная конденсация хромосом и растворение ядерной оболочки в гетерокарионе 1 — митотические хромосомы донорской клетки; 2 — ядро клетки-реципиента |
Сходная динамика совпадения процессов перестройки хромосом и ядерной оболочки наблюдается и в другой системе — в цитоплазме ооцитов или в бесклеточных цитоплазматических экстрактах ооцитов. Так, если в цитоплазму ооцита амфибий на стадии метафазы инъецировать выделенные интерфазные ядра, то их ядерная оболочка разбирается, а хроматин конденсируется в виде митотических хромосом. Если в ооцит на стадии интерфазы ввести митотические хромосомы, то они начинают деконденсироваться, появляются множественные мелкие вакуоли, которые, сливаясь друг с другом, образуют ядерные оболочки. Интересно, что в цитоплазму интерфазного ооцита можно ввести даже чужеродную чистую ДНК, которая, связываясь с гистонами в цитоплазме, образует хроматиновые глыбки, которые в свою очередь одеваются ядерными оболочками и превращаются в микроядра.
Эти экспериментальные приемы вместе с методом иммунофлуоресценции позволили проследить судьбу многих белков ядерной оболочки во время митоза. Подробно изучена судьба ламинов. Найдено, что фиброзный слой ламинов деполимеризуется параллельно распаду ядерных мембран и конденсации хроматина. Этому предшествует обильное (в 7 раз выше, чем в интерфазе) фосфорилирование ламинов. Ламины А и С при этом деполимеризуются до димеров и тетрамеров и, переходя в растворимое состояние, равномерно распределяются в цитоплазме вне связи с другими структурами. Ламин В тоже деполимеризуется до олигомеров, но остается связанным с мембранными пузырьками, возникшими из ядерной оболочки.
При сборке ядерной оболочки в телофазе белки ламины иммунохимически начинают выявляться в центромерных и теломерных участках хромосом. Там же обнаруживаются первые признаки образования новой ядерной оболочки и накапливаются антитела к белкам порового комплекса. В бесклеточной системе цитоплазматического экстракта ооцитов было показано, что ассоциация растворимых в митозе ламинов А и С происходит независимо от ламина В. Оказалось, что если систему реконструкции ядерной оболочки лишить ламина В, то ламины А и С связываются с поверхностью хромосом, но сборки ядерной оболочки не происходит. В экстракте, лишенном ламинов А и С, ламин В связывается с хромосомами, но нормальная ядерная оболочка также не формируется.

Величко В.В. © Copyright 2008.![]()
![]()