О проекте
О проекте
 Предмет клеточной
Предмет клеточной
 Строение и химия
Строение и химия
 Цитоплазма
Цитоплазма
 Системы
Системы
 Цитоскелет
Цитоскелет
 Механизмы
МеханизмыМИТОХОНДРИИ: СТРОЕНИЕ И ФУНКЦИИ

Митохондрии как органеллы синтеза АТФ характерны, за малым исключением, для всех эукариотических клеток как аутотрофных (фотосинтезирующие растения), так и гетеротрофных (животные, грибы) организмов. Их основная функция связана с окислением органических соединений и использованием освобождающейся при распаде этих соединений энергии в синтезе молекул АТФ. Поэтому митохондрии часто называют энергетическими станциями клетки.

Общая морфология
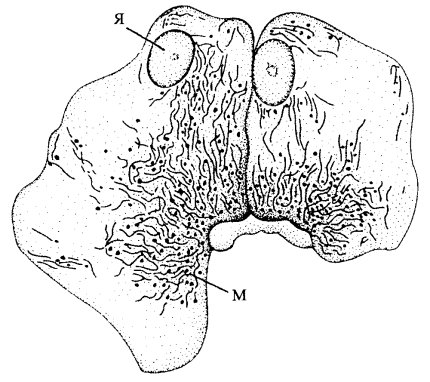
Митохондрии, или хондриосомы (от греч. mitos — нить, chondrion — зернышко, soma — тельце), представляют собой гранулярные или нитевидные органеллы, присутствующие в цитоплазме простейших, растений и животных (рис. 198). Митохондрии можно наблюдать в живых клетках, так как они обладают достаточно высокой плотностью. В живых клетках митохондрии могут двигаться, перемещаться, сливаться друг с другом. Особенно хорошо митохондрии выявляются на препаратах, окрашенных различными способами после осмиевой фиксации, которая хорошо стабилизирует липиды. Наиболее широко распространен метод окраски по Альтману, который описал эти клеточные органеллы в конце позапрошлого века, называя их «биобластами».
|
Рис. 198. Митохондрии в клетках печени (рисунок Альтмана, 1880) Я — ядро; М — митохондрии |
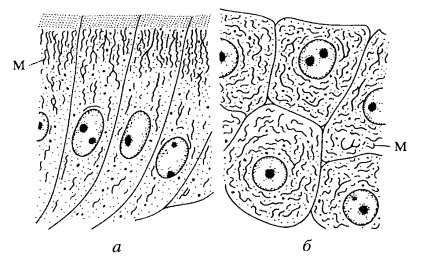
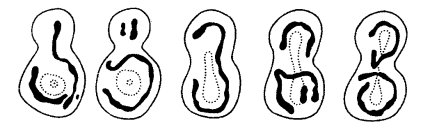
Размеры митохондрий, как и их форма, очень непостоянны у разных видов (рис. 199). Все же у большинства клеток толщина этих структур относительно постоянна (около 0,5 мкм), а длина колеблется, достигая у нитчатых форм до 7—60 мкм. Надо сказать, что изучение величины митохондрий — не простое дело. В световом микроскопе на окрашенных препаратах не всегда можно проследить за реальными размерами митохондрий (рис. 200 и 201, а). Изучая митохондрии с помощью электронного микроскопа на ультратонких срезах, трудно решить вопрос об истинной длине митохондрий, так как на срез попадает только незначительный объем данной митохондрии. Более того, на срезе одна извитая митохондрия может быть представлена несколькими сечениями (3—5), и только пространственная трехмерная реконструкция, построенная на изучении серийных срезов, может решить вопрос, имеем ли мы дело с 3—6 отдельными митохондриями или же с одной изогнутой или разветвленной. Выделенные митохондрии обычно повреждаются и фрагментируются, что также ограничивает использование этого метода для решения вопроса о величине и числе митохондрий.
|
Рис. 199. Разнообразие митохондрий (М) в клетках кишечника лягушки (а) и в гепатоцитах зародыша свиньи (6) |
|
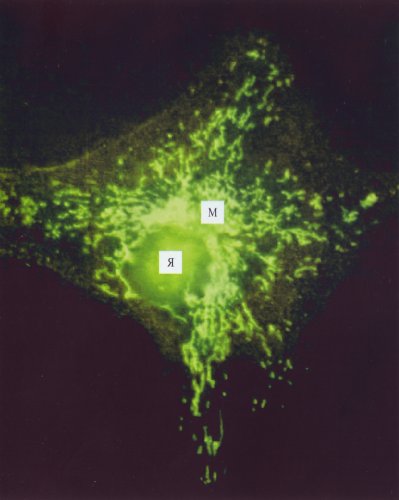
Рис. 200. Флуоресцирующие митохондрии (М) в клетке культуры ткани при окраске родамином (фото А.А. Минина) Я - ядро |
|
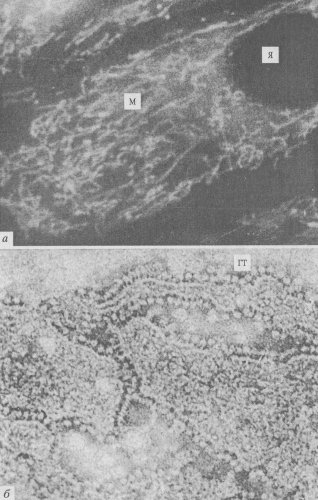
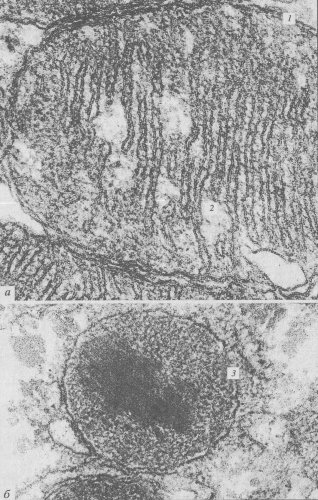
Рис. 201 . Митохондрии (М) в клетке культуры ткани, окрашенные прижиз ненно родамином (а), и выделенные внутренние мембраны митохондрий при негативном контрастировании (б), где в электронном микроскопе видны «грибовидные тельца» (ГТ) (молекулы АТФ-синтетазы) (фото Л.Е. Бакесвой) Я - ядро |
В последнее время вопрос о величине и числе митохондрий занимает многих исследователей в связи с тем, что на ряде объектов показано: размеры и число митохондрий, которые видны на ультратонких срезах, не соответствуют реальности. Так, в клетках дрожжей на срезах выявляется 5-7 сечений митохондрий; можно высчитать, что это число соответствует нескольким десяткам митохондрий. Однако при использовании высоковольтной электронной микроскопии, позволяющей исследовать объекты толщиной до нескольких микрон, было обнаружено, что в клетках дрожжей есть всего лишь несколько (1—3) сильно разветвленных митохондрий (рис. 202). Есть данные, что число митохондрий и для других клеток завышено из-за сложности структуры разветвленных митохондрий. Более того, появились представления о том, что в одноклеточных организмах есть всего одна митохондрия, но сильно разветвленная. Например, у трипаносом в клетке присутствует одна гигантская митохондрия, имеющая сложную разветвленную форму.
|
Рис. 202. Митохондрии в делящихся клетках дрожжей Candida albicane (Tanaka, Kanbe, 1985) |
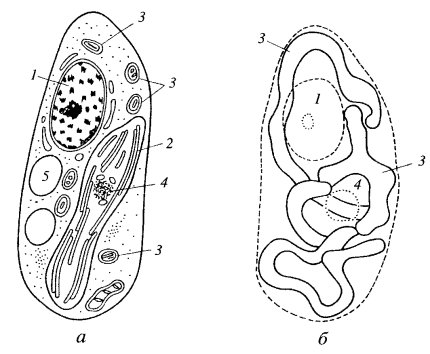
Гигантские одиночные митохондрии были описаны для одноклеточных зеленых водорослей (Polytomella, Euglena, Chlorella) (рис. 203). Длинные ветвящиеся митохондрии описаны в клетках культуры ткани млекопитающих, в клетках многих растений как в нормальных, так и в анаэробных условиях. В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин. Этот краситель обладает способностью люминесцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминесцентном микроскопе видна единая митохондриальная система — митохондриальный ретикулум (см. рис. 200 и 201, а).
|
Рис. 203. Гигантская митохондрия в клетке Chlorella fusca а — срез клетки; 6 — трехмерная реконструкция митохондрии. 1 — ядро; 2 — хлоропласт; 3 — митохондрия; 4 — пиреноид; 5 — вакуоль |
Обычные подсчеты показывают, что на печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объема цитоплазмы и около 30-35% от общего количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4—5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300 000) и у гигантской амебы Chaos chaos (до 500 000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты.
В спермиях часто присутствуют гигантские митохондрии, спирально закрученные вокруг осевой части жгутика. Отсутствуют митохондрии у кишечных энтамеб, живущих в условиях анаэробиоза, и у некоторых других паразитических простейших.
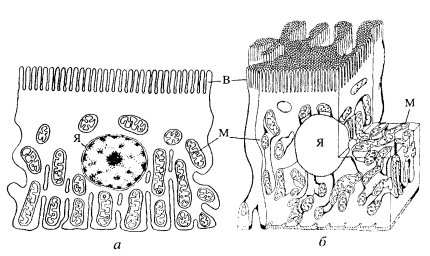
Локализация митохондрии в клетках может быть различной. Часто их расположение обусловлено топографией цитоплазматических структур и включений. Так, в дифференцированных клетках растений митохондрии большей частью расположены в периферических участках цитоплазмы, отодвинутых к плазматической мембране центральной вакуолью. В мало дифференцированных клетках меристемы растений митохондрии располагаются более или менее равномерно. В клетках эпителия почечных канальцев митохондрии ориентированы вдоль продольной оси клетки. Это связано с тем, что они располагаются между глубокими впячиваниями плазматической мембраны в базальной области клеток (рис. 204).
|
Рис. 204. Митохондриальный ретикулум в базальной части клетки извитого канальца почки крысы (Bergeron et at., 1980) а — срез клетки; б — трехмерная реконструкция. М — митохондрии; В — микроворсинки; Я — ядро |
Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях. Например, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с необходимостью использования АТФ для движения хвоста сперматозоида. Аналогичным образом у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса. В секреторных клетках, которые синтезируют большие количества белков, митохондрии тесно связаны с зонами эргастоплазмы; вероятно, они поставляют АТФ для активации аминокислот и синтеза белка на рибосомах.

Ультраструктура митохондрий
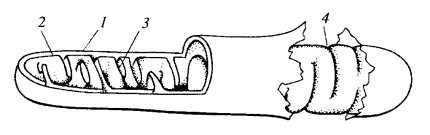
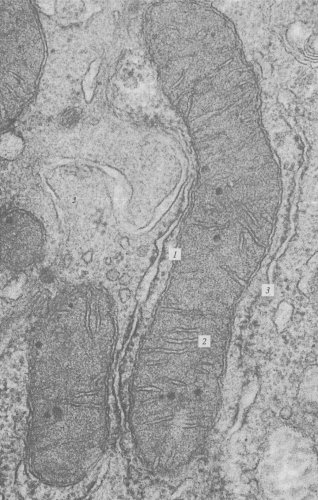
Митохондрии независимо от их величины или формы имеют универсальное строение, их ультраструктура однообразна. Митохондрии ограничены двумя мембранами (рис. 205). Наружняя митохондриальная мембрана отделяет ее от гиалоплазмы. Обычно она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Толщина этой мембраны около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружную мембрану от внутренней отделяет межмембранное пространство шириной около 10—20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии, ее матрикс, или митоплазму. Характерной чертой внутренних мембран митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист (рис. 206 и 207, а).
|
Рис. 205. Схема общей организации митохондрии 1 — внешняя мембрана; 2 — внутренняя мембрана; 3 — впячивания внутренней мембраны - кристы; 4 — места впячиваний, вид с поверхности внутренней мембраны |
|
Рис. 206. Микрофотография митохондрий в клетках печени, полученная с помощью электронного микроскопа 1 — внешняя и внутренняя мембраны; 2 — кристы; 3 — ЭПР |
|
Рис. 207. Микрофотографии митохондрии (а) и пероксисомы (б) в клетках печени, полученные с помощью электронного микроскопа (фото Л.Е. Бакеевой) 1 — внешняя и внутренняя мембраны; 2 — кристы (видна бислойность мембран); 3 — одиночная ограничивающая мембрана пероксисомы |
Общая поверхность внутренней мембраны митохондрии в печеночной клетке составляет примерно треть поверхности всех клеточных мембран. Митохондрии клеток сердечной мышцы содержат втрое больше крист, чем печеночные митохондрии. Это может отражать различия в функциональных нагрузках митохондрий разных клеток. Расстояние между мембранами в кристе составляет около 10-20 нм. На срезах связь мембраны крист с внутренней мембраной прослеживается очень отчетливо, но мест таких мембранных переходов немного. Это объясняется тем, что связь между мембранами осуществляется через узкую шейку, или стебелек.
Митохондриальные кристы, отходящие от внутренней мембраны и простирающиеся в сторону матрикса, обычно не полностью перегораживают полость митохондрии, не нарушают непрерывности заполняющего ее матрикса.
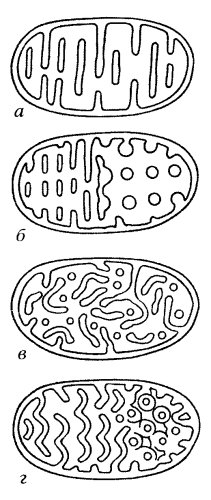
Ориентация крист по отношению к длинной оси митохондрии различна для разных клеток. Так, может быть перпендикулярная ориентация (клетки печени, почек) крист; в некоторых клетках (сердечная мышца) наблюдается продольное расположение крист. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации (рис. 208). У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
|
Рис. 208. Варианты строения крист митохондрий а — пластинчатые кристы (печень); б — перфорированные кристы (летательная мышца мухи); в — трубчатые кристы; г — волнистые кристы (амеба) |
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2—3 нм) и гранулы около 15—20 нм. Известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы — митохондриальные рибосомы. Кроме того, в матриксе встречаются крупные (20—40 нм) плотные гранулы, это — места отложения солей магния и кальция.

Функции митохондрий
Митохондрии осуществляют синтез АТФ, происходящий в результате процессов окисления органических субстратов и фосфорилирования АДФ. В клетках окисление и выделение энергии, освобождающейся в результате этого процесса, проходят в несколько взаимосвязанных этапов. При этом в качестве начальных субстратов используются различные углеводы, жирные кислоты, аминокислоты. Первые этапы окисления приводят кроме образования АТФ к появлению промежуточных продуктов, конечное окисление которых в митохондриях дает возможность клетке использовать этот процесс для синтеза основного количества АТФ.
Начальные этапы окисления углеводов происходят в гиалоплазме и не требуют участия кислорода. Поэтому они называются анаэробным окислением, или гликолизом. Главным субстратом окисления при анаэробном получении энергии служат гексозы и в первую очередь глюкоза; некоторые бактерии обладают свойством извлекать энергию, окисляяя пентозы, жирные кислоты или аминокислоты. В глюкозе количество потенциальной энергии, заключенной в связях между атомами С, Н и О, составляет около 680 ккал на 1 моль (т.е. на 180 г глюкозы); эта энергия освобождается при полном окислении глюкозы согласно следующей реакции:
С6Н12О6 + 6О2 → 6Н2О + 6СО2 + 680 ккал.
В живой клетке это огромное количество энергии не освобождается одновременно, как при горении в пламени. Освобождение энергии идет в виде ступенчатого процесса, управляемого целым рядом окислительных ферментов, и не связано с переходом энергии химической связи в тепло, как при горении, а с переходом ее в макроэнергетическую связь в молекуле АТФ, которая синтезируется при использовании освобождающейся энергии из АДФ и фосфата.
В процессе гликолиза происходит неполное окисление субстрата. В результате гликолиза глюкоза распадается до триоз, при этом тратятся 2 молекулы АТФ и синтезируются 4 молекулы АТФ. Так что в конечном результате клетка «зарабатывает» всего 2 молекулы АТФ. В энергетическом отношении этот процесс малоэффективен, поэтому из 680 ккал, заключающихся в связях 1 моля глюкозы, освобождается менее 10% энергии. Несмотря на низкий энергетический выход, анаэробное окисление — гликолиз, широко используется в живой природе. Он является основным поставляющим энергию процессом для многих микроорганизмов, некоторых кишечных паразитических анаэробных простейших, для клеток высших организмов на ранних стадиях эмбрионального развития, для многих опухолевых клеток, для клеток культуры ткани и др. Эритроциты млекопитающих, например, получают всю необходимую им энергию за счет гликолиза, так как у них нет митохондрий.
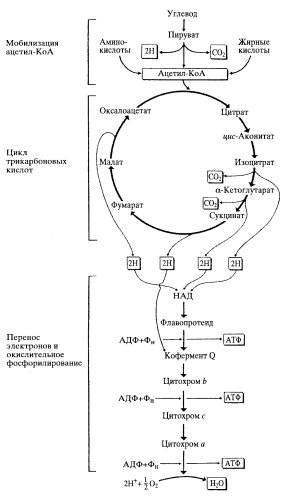
Образовавшиеся в результате гликолиза триозы, в первую очередь пировиноградная кислота, вовлекаются в дальнейшее окисление, осуществляющееся уже в самих митохондриях. При этом происходит использование энергии расщепления всех химических связей, что приводит к выделению СО2, к потреблению кислорода и синтезу большого количества АТФ. Эти процессы связаны с окислительным циклом трикарбоновых кислот и с дыхательной цепью переноса электронов, где совершаются фосфорилирование АДФ и синтез клеточного «топлива» — молекул АТФ (рис. 209).
|
Рис. 209. Схема цикла трикарбоновых кислот и окислительного фосфорилирования |
В цикле трикарбоновых кислот (цикл Кребса, или цикл лимонной кислоты) образовавшийся в результате гликолиза пируват сначала теряет молекулу СО2 и, окисляясь до ацетата (двууглеродное соединение), соединяется с коферментом А. Затем ацетилкоэнзим А, соединяясь с оксалацетатом (четырехуглеродное соединение), образует шестиуглеродный цитрат (лимоную кислоту). Далее происходит цикл окисления этого шестиуглеродного соединения до четырехуглеродного оксалацетата, который снова связывается с ацетилкоэнзимом А; затем цикл повторяется. При этом окислении выделяются две молекулы СО2 , а электроны, освободившиеся при окислении, переносятся на акцепторные молекулы коферментов (НАД — никотинамидадениндинуклеотид), которые вовлекают их далее в цепь переноса электронов. Следовательно, в цикле трикарбоновых кислот нет самого синтеза АТФ, а идет окисление молекул, перенос электронов на акцепторы и выделение СО2. Все описанные выше события внутри митохондрий происходят в их матриксе.
Выделенные митохондрии могут окислять пируват до СО2 и способны к синтезу АТФ. Если взвесь митохондрий подвергнуть воздействию ультразвука, то после разрыва митохондриальных мембран компоненты матрикса освобождаются и переходят в среду выделения. После такого разрушения можно осадить мембраны митохондрий и анализировать их функциональные активности.
Во фракции, свободной от мембран, представляющей собой компоненты матрикса, обнаруживаются ферменты, участвующие в цикле трикарбоновых кислот. Следовательно, в матриксе локализованы ферменты этого цикла, которые находятся в свободном состоянии: они не связаны с митохондриальными мембранами, за исключением сукцинатдегидрогеназы. Кроме того, в состав матрикса входят ферменты окисления жирных кислот; основной продукт окисления жирных кислот — ацетилкоэнзим А (ацетил-КоА) — тоже в матриксе поступает в цикл трикарбоновых кислот, в котором он подвергается дальнейшему окислению до СО2 и Н2О. В матриксе митохондрий происходит также окисление некоторых аминокислот, поступающих в цикл трикарбоновых кислот.
В остальных событиях, связанных с дальнейшим переносом электронов и синтезом АТФ, участвует внутренняя митохондриальная мембрана с кристами митохондрий.
Освободившиеся в процессе окисления в цикле трикарбоновых кислот электроны, акцептированные на коферментах, переносятся затем в дыхательную цепь (цепь переноса электронов), где они соединяются с молекулярным кислородом, образуя молекулы воды.
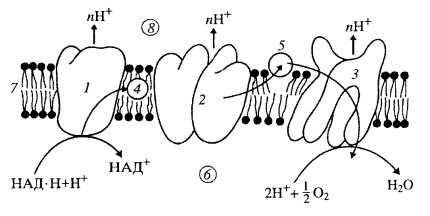
Дыхательная цепь представляет собой ряд белковых комплексов, встроенных во внутреннюю митохондриальную мембрану (рис. 210). Существуют три главных ферментных комплекса. Первый, НАД·Н-дегидрогеназный комплекс принимает электроны от НАД·Н и переносит их во второй комплекс — комплекс Ь—с1 который в свою очередь переносит их на цитохромоксидазный комплекс, а он их передает на кислород, в результате чего образуется вода. На этом окисление заканчивается.
|
Рис. 210. Поток электронов через три главных ферментативных комплекса при переносе электронов от НАД·Н к О2 1 — НАД·Н-дегидрогеназный комплекс; 2 — с1-комплекс; 3 — цитохромоксидазный комплекс; 4 — убихинон; 5 — цитохром с; 6 — матрикс митохондрии; 7 — внутренняя митохондриальная мембрана; 8 — межмембранное пространство |
Как и полагается, окисление исходного субстрата привело к выделению СО2 и воды, но при этом не выделилась тепловая энергия, как при горении, а образовались молекулы АТФ. Они были синтезированы другой группой белков, не связанных прямо с окислением. Было найдено, что во внутренних митохондриальных мембранах, на поверхности мембран, смотрящих в матрикс, располагаются крупные белковые комплексы, ферменты, АТФ-синтетазы. В электронном микроскопе во фракции внутренних митохондриальных частиц видны так называемые грибовидные тельца, сплошь выстилающие поверхность мембран, смотрящую в матрикс. Эти тельца имеют как бы ножку и головку диаметром 8—9 нм. Эти тельца представляют собой белковый комплекс, состоящий из 9 субъединиц, — АТФ-синтетазу. Следовательно, во внутренних мембранах митохондрий локализованы ферменты как окислительной цепи, так и синтеза АТФ (см. рис. 201, 6).
Дыхательная цепь — это главная система превращения энергии в митохондриях. В ней последовательно окисляются и восстановливаются элементы дыхательной цепи, в результате чего высвобождается небольшими порциями энергия. За счет этой энергии в трех точках этой цепи из АДФ и фосфата образуется АТФ. Поэтому говорят, что окисление (перенос электронов) сопряжено с фосфорилированием (АДФ + Фн → АТФ), т.е. происходит процесс окислительного фосфорилирования.
В результате многократной оборачиваемости субстратов в цикле Кребса полностью окисляются поступившие продукты первичного гликолитического окисления. Затем в цепи окислительного фосфорилирования энергия, освободившаяся при окислении, максимально используется для синтеза АТФ.
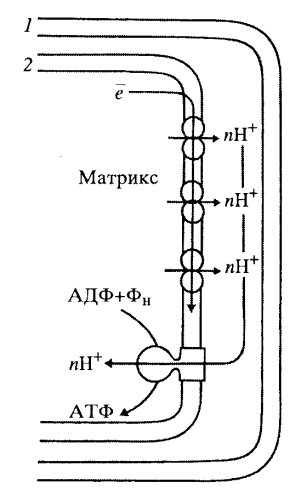
Было высказано предположение, что выделяющаяся при транспорте электронов энергия запасается в виде градиента протонов на мембране. При этом на внешней поверхности внутренней мембраны митохондрий возникает повышенная концентрация положительно заряженных ионов водорода. Возникший при этом протонный градиент является движущей силой в синтезе АТФ (рис. 211).
|
Рис. 211. Общая схема окислительного фосфорилирования по П. Митчеллу При переносе электронов по цепи окисления протоны накапливаются в межмембранном пространстве и при достижении определенного потенциала возвращаются в матрикс, при этом на АТФ-синтетазном комплексе происходит синтез АТФ. 1 — внешняя мембрана; 2 — внутренняя мембрана; Фн — неорганический фосфат |
Это предположение стало затем теорией, хемиосмотической теорией сопряжения окисления субстратов с синтезом АТФ. Как оказалось, при переносе электронов в митохондриальной мембране каждый комплекс дыхательной цепи направляет свободную энергию окисления на перемещение протонов (положительных зарядов) через мембрану из матрикса в межмембранное пространство, что приводит к образованию разности потенциалов на мембране; положительные заряды преобладают в межмембранном пространстве, а отрицательные — со стороны матрикса митохондрий. При достижении определенной разности потенциалов (220 мВ) белковый комплекс АТФ-синтетазы начинает транспортировать протоны обратно в матрикс, при этом превращает одну форму энергии в другую; образует АТФ из АДФ и неорганического фосфата. Так происходит сопряжение окислительных процессов с синтетическим, с фосфорилированием АДФ. Пока совершается окисление субстратов, пока осуществляется перекачка протонов через внутреннюю митохондриальную мембрану, идет сопряженный с этим синтез АТФ, т.е. происходит окислительное фосфорилирование.
Эти два процесса можно разобщить. Для этого достаточно снять разность потенциалов на митохондриальной мембране, сделав в ней диффузионные каналы, или ее механическим нарушением, или с помощью химических соединений (например, динитрофенола). При этом перенос электронов и окисление субстрата будут продолжаться, но синтеза АТФ уже не будет. В этом случае энергия, освобождающаяся при окислении, перейдет в тепловую энергию.

Окислительное фосфорилирование у бактерий
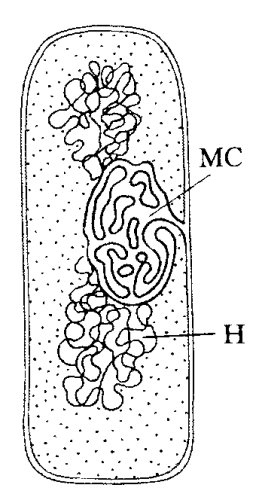
У прокариотических клеток, способных к окислительному фосфорилированию, элементы цикла трикарбоновых кислот локализованы прямо в цитоплазме, а ферменты дыхательной цепи и фосфорилирования связаны с клеточной, плазматической мембраной. Вначале это было показано цитохимическими методами. Так, фермент сукцинатдегидрогеназа связан с плазматической мембраной и с ее выпячиваниями, выступающими внутрь цитоплазмы, с так называемыми мезосомами (рис. 212). Необходимо отметить, что такие бактериальные мезосомы могут быть связаны не только с процессами аэробного дыхания, но у некоторых видов участвуют в делении клеток, в процессе распределения ДНК по новым клеткам, в образовании клеточной стенки и т.д. На плазматической мембране в мезосомах некоторых бактерий локализуются также факторы сопряжения окисления и синтеза АТФ. С помощью электронного микроскопа во фракциях плазматических мембран бактерий обнаружены сферические частицы, аналогичные тем, которые были найдены в митохондриях эукариотических клеток. Таким образом, у бактериальных клеток, способных к окислительному фосфорилированию, плазматическая мембрана выполняет роль, аналогичную внутренней мембране митохондрий эукариотических клеток.
|
Рис. 212. Мезосомы (МС) бактериальных клеток Н — нуклеоид |

Увеличение числа митохондрий
Как и другие органеллы цитоплазмы, митохондрии могут увеличиваться в числе, что особенно заметно при делении клеток или при увеличении функциональной нагрузки клетки. Более того, митохондрии постоянно обновляются. Так, в печени средняя продолжительность жизни митохондрий составляет около 10 дней. Поэтому закономерно возникает вопрос: каким образом происходит это увеличение числа митохондрий, за счет каких процессов и каких структур образуются новые митохондрии?
Основная масса экспериментальных данных говорит о том, что увеличение числа митохондрий происходит путем роста и деления предшествующих митохондрий. Это предположение было впервые высказано Альтманом (1893), описавшим митохондрии под термином «биобласты». Позднее с помощью цейтраферной киносъемки удалось наблюдать прижизненное деление, фрагментацию длинных митохондрий на более короткие. Особенно отчетливо виден этот процесс при делении клеток некоторых одноклеточных водорослей и низших грибов, у которых деление митохондрий скоординировано с клеточным делением. С помощью электронного микроскопа часто во многих клетках можно видеть деление митохондрий путем образования перетяжки (рис. 213), например в клетках печени (хотя без доказательств динамичности этого процесса такие наблюдения мало убедительны). Внешне все эти картины очень напоминают бинарный способ деления бактерий.
|
Рис. 213. Возможные пути деления митохондрий при образовании перегородок (а) или перетяжки (б) (по: Muhlethaler , 1959) |
Реапьность увеличения числа митохондрий путем деления была доказана при изучении поведения митохондрий в живых клетках культуры ткани. Обнаружено, что в течение клеточного цикла митохондрии могут вырастать до нескольких микрометров, а затем фрагментироваться, делиться на более мелкие тельца.
Кроме того, митохондрии могут сливаться друг с другом. Так, в культуре клеток эндотелия сердца головастика ксенопуса выявляли до 40 случаев слияния и деления митохондрий за 1 ч. В клетках культуры почек эмбрионов наблюдали рост и ветвление митохондрий в S-периоде клеточного цикла. Однако уже в G2-периоде преобладали в числе мелкие митохондрии, образовавшиеся за счет деления при фрагментации длинных митохондрий. Таким образом, размножение митохондрий идет по принципу: omnis mitochondrion e mitochondrion.
Интересны наблюдения за судьбой митохондрий в дрожжевых клетках. В аэробных условиях дрожжевые клетки имеют типичные митохондрии с четко выраженными кристами. При переносе клеток в анаэробные условия (например, при их пересеве или при перемещении в атмосферу азота) типичные митохондрии в их цитоплазме не обнаруживаются, и вместо них видны мелкие мембранные пузырьки. Оказалось, что в анаэробных условиях дрожжевые клетки не содержат полную дыхательную цепь (отсутствуют цитохромы b и а). При аэрации культуры обнаруживается быстрая индукция биосинтеза дыхательных ферментов, резкое повышение потребления кислорода, а в цитоплазме появляются нормальные митохондрии. Эти наблюдения привели к представлению о том, что у дрожжей в анаэробных условиях в цитоплазме существуют промитохондриальные структуры с редуцированной системой окисления. Такие промитохондрии при переносе клеток в условия аэробной среды начинают перестраиваться, происходит включение в их мембраны элементов полной цепи окисления и фосфорилирования, что сопровождается изменением их морфологии. Так, из примитивных, неактивных промитохондрии путем их достройки и роста образуются обычные функционирующие митохондрии.
Вероятно, сходные процессы протекают и при делении митохондрий: увеличивается масса митохондриальных мембран со всеми специфическими компонентами за счет синтеза и включения в них отдельных белков - ферментов и липидов, нарастает масса белков матрикса, а затем происходит деление как бы удвоившейся или многократно увеличившейся структуры.
Эти представления получают поддержку со стороны фактов, касающихся организации и состава митохондриального матрикса или митоплазмы, в которой обнаружены ДНК, разные типы РНК и рибосомы.

Авторепродукция митохондрий
Исследования последних лет привели к удивительным открытиям: двумембранные органеллы обладают полной системой авторепродукции. Эта система полная в том смысле, что в митохондриях и пластидах открыта ДНК, на которой синтезируются информационные, трансферные и рибосомные РНК и рибосомы, осуществляющие синтез митохондриальных и пластидных белков. Однако, как оказалось, эти системы, хотя и автономны, очень ограничены по своим возможностям.
ДНК в митохондриях представлена циклическими молекулами, не образующими связь с гистонами, в этом отношении они напоминают бактериальные хромосомы. Размер их невелик, около 7 мкм; в одну циклическую молекулу митохондрий животных входит 16—19 т.п.н. ДНК. У человека митохондриальная ДНК содержит 16,5 т.п.н., она полностью расшифрована. Митохондральная ДНК различных объектов очень однородна, отличие их заключается лишь в величине интронов и нетранскрибируемых участков. Все митохондриальные ДНК представлены множественными копиями, собранными в группы, - кластеры. Так, в одной митохондрии печени крысы может содержаться от 1 до 50 циклических молекул ДНК. Общее же количество митохондриальной ДНК на клетку составляет около 1%. Синтез митохондриальных ДНК не связан с синтезом ДНК в ядре.
Как и у бактерий, митохондральная ДНК собрана в отдельную зону - нуклеоид, его размер составляет около 0,4 мкм в диаметре. В длинных митохондриях может быть от 1 до 10 нуклеоидов. При делении длинной митохондрии от нее отделяется участок, содержащий нуклеоид (сходство с бинарным делением бактерий). Количество ДНК в отдельных нуклеоидах митохондрий может колебаться в 10 раз в зависимости от типа клеток.
Прижизненно нуклеоиды митохондрий могут окрашиваться специальными флуорохромами. Оказалось, что в некоторых культурах в клетках от 6 до 60% митохондрий не имеют нуклеоида, что может объясняться тем, что деление этих органелл скорее связано с фрагментацией, а не с распределением нуклеоидов.
Как уже говорилось, митохондрии могут как делиться, так и сливаться друг с другом. В обычной культуре клеток человека HeLa все митохондрии содержат нуклеоиды. Однако одна из мутантных линий этой культуры содержала митохондрии, в которых нуклеоиды с помощью флуорохромов не выявлялись. Но если эти мутантные клетки слить с цитопластами клеток исходного типа, то во всех митохондриях обнаруживались нуклеоиды. Это говорит о том, что при слиянии митохондрий друг с другом может происходить обмен их внутренними компонентами.
Важно подчеркнуть, что рРНК и рибосомы митохондрий резко отличны от таковых в цитоплазме. Если в цитоплазме выявляются 80S рибосомы, то рибосомы митохондрий растительных клеток принадлежат к 70S рибосомам (состоят из 30S и 50S субъединиц, содержат 16S и 23S РНК, характерные для прокариотических клеток), а в митохондриях клеток животных обнаружены более мелкие рибосомы (около 50S).
Рибосомные РНК митохондрий синтезируются на митохондриальных ДНК. В митоплазме на рибосомах идет синтез белков. Он прекращается, в отличие от синтеза на цитоплазматических рибосомах, при действии антибиотика хлорамфеникола, подавляющего синтез белка у бактерий.
На митохондриальном геноме синтезируются и транспортные РНК, всего синтезируется 22 тРНК. Триплетный код митохондриальной синтетической системы отличен от такового, используемого в гиалоплазме. Несмотря на наличие казалось бы всех компонентов, необходимых для синтеза белков, небольшие молекулы митохондриальной ДНК не могут кодировать все митохондриальные белки, а лишь их небольшую часть. Так, ДНК размером 15 т.п.н. может кодировать белки с суммарной молекулярной массой около 6·105. В то же время суммарная молекулярная масса белков частицы полного дыхательного ансамбля митохондрии достигает величины около 2·106. Если учесть, что кроме белков окислительного фосфорилирования в митохондрии входят ферменты цикла трикарбоновых кислот, ферменты синтеза ДНК и РНК, ферменты активации аминокислот и другие белки, то видно, что для кодирования этих многочисленных белков и рРНК и тРНК количества генетической информации в короткой молекуле митохондриальной ДНК явно не хватает. Расшифровка нуклеотидной последовательности митохондриальной ДНК человека показала, что она кодирует всего лишь 2 рибосомные РНК, 22 трансферные РНК и всего 13 различных полипептидных цепей.
В настоящее время имеются убедительные доказательства, что большая часть белков митохондрий находится под генетическим контролем со стороны клеточного ядра и синтезируется вне митохондрий. Так, цитохром с образуется в гиалоплазме, а из девяти полипептидных цепей в составе АТФ-синтетазы только одна синтезируется в матриксе митохондрий животных. Митохондриальная ДНК кодирует лишь немногие митохондриальные белки, которые локализованы в мембранах и представляют собой структурные белки, ответственные за правильную интеграцию в митохондриальных мембранах отдельных функциональных компонентов.
Большинство митохондриальных белков синтезируется на рибосомах в цитозоле. Эти белки имеют специальные сигнальные последовательности, которые узнаются рецепторами на внешней мембране митохондрий. Эти белки могут встраиваться в них (см. аналогию с мембраной пероксисом), а затем перемещаться на внутреннюю мембрану. Этот перенос происходит в точках контакта наружной и внутренней мембран, где такой транспорт отмечен (рис. 214). Большинство липидов митохондрий так же синтезируются в цитоплазме.
|
Рис. 214. Схема переноса белков из цитоплазмы в митохондрии через область контакта митохондриальных мембран а — транспорт белка в матрикс митохондрий; б — включение белка во внутреннюю митохондриальную мембрану. 1 — внешняя мембрана митохондрии; 2 — внутренняя мембрана митохондрии; 3 — канальные белки; 4 — транспортируемый белок матрикса; 5 — сигнальный конец белка; 6 — белок в матриксе; 7 — транспортируемый белок внутренней мембраны; 8 — второй сигнальный пептид; 9 — перенос белка в матрикс; 10 — второй сигнальный участок белка, встраивающийся в мембрану; 11 — встроенный белок внутренней мембраны |
Все эти открытия, показывающие относительно независимое строение и функционирование системы белкового синтеза митохондрий, возродили гипотезу о эндосимбиотическом происхождении митохондрий, о том, что митохондрии представляют собой организмы типа бактерий, находящиеся в симбиозе с эукариотический клеткой.

Хондриом
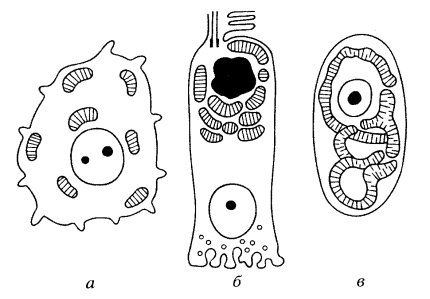
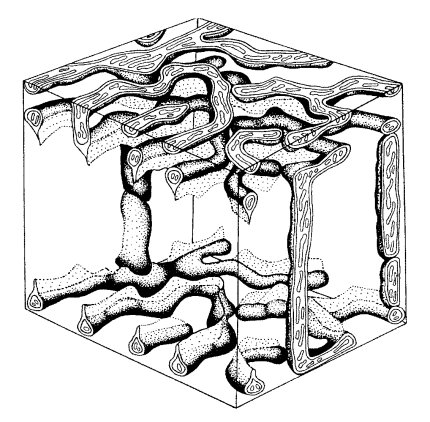
Хондриом — это совокупность всех митохондрий в одной клетке. Оказалось, что такая совокупность может быть различной в зависимости от типа клеток. Так, во многих клетках хондриом представлен разрозненными многочисленными митохондриями, разбросанными довольно равномерно по всей цитоплазме, как, например, во многих недифференцированных клетках (рис. 215, а). В других случаях отдельные митохондрии локализуются группами в местах интенсивной траты АТФ, как, например, в клетках анализаторов сетчатки. В обоих этих случаях митохондрии функционируют поодиночке, их кооперативная работа, возможно, координируется какими-то сигналами из цитоплазмы. Однако существует и совершенно иной тип хондриома, когда вместо мелких одиночных разрозненных митохондрий в клетке располагается одна гигантская разветвленная митохондрия (рис. 215, в). Такие митохондрии часто встречаются у одноклеточных зеленых водорослей (например, у Chlorella). В этих случаях мы видим не отдельные митохондрии, а сложную митохондриальную систему, сеть, или, как ей дали название, митохондриальный ретикулум (reticulum mitochondriale). Каков биологический смысл появления такой гигантской разветвленной митохондриальной структуры, объединенной в одно целое своими внешними и внутренними мембранами? Согласно хемоосмотической теории, возникший на поверхности внутренней мембраны электрохимический протонный градиент равномерно распределяется по поверхности внутренней мембраны митохондрий, т.е. она эквипотенциальна в любой своей точке. Поэтому в любой точке поверхности внутренней мембраны такой разветвленной митохондрии может идти синтез АТФ, который будет поступать в любую точку цитоплазмы, где в этом есть необходимость, т.е. такие разветвленные митохондрии могут представлять собой «электрический кабель».
|
Рис. 215. Разные формы хондриома а — разрозненные митохондрии; б — группы митохондрий; в — митохондриальный ретикулум |
То, что это действительно имеет место, было доказано экспериментально. Были выбраны растущие в культуре ткани фибробласты, в цитоплазме которых имеются длинные нитчатые митохондрии, достигающие 60 мкм. В живых клетках их можно наблюдать с помощью флуорохрома этилродамина, который накапливается в матриксе только работающих, синтезирующих АТФ, митохондрий. Если снять разность потенциалов на внутренней мембране митохондрий, воздействуя на клетки динитрофенолом, то свечение этилродамина в митохондриях прекращается параллельно падению синтеза АТФ. При этом гашение флуоресценции происходит во всех митохондриях. Это наблюдение показывает, что этилродамин, как протонный краситель, накапливается в матриксе митохондрий только тогда, когда есть разность потенциалов на внутренней мембране митохондрий, т.е. когда осуществляется синтез АТФ.
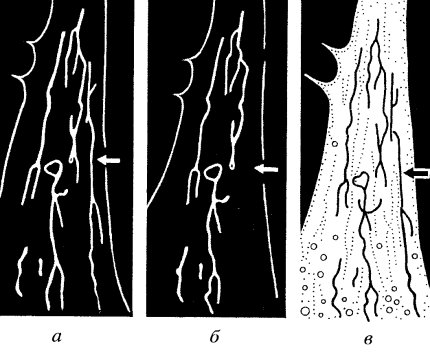
Но динитрофенол, встраиваясь в мембрану, создает «пробой» на всех митохондриях данной клетки. А как «выключить» одну митохондрию? Для этого используется лазерный или ультрафиолетовый микролуч, который можно точно направить на избранную экспериментатором митохондрию (рис. 216). Делается это с помощью специальной оптической системы, которая позволяет одновременно рассматривать объект (в данном случае живые клетки с окрашенными родамином митохондриями) и навести на избранную деталь тонкий пучок лазера или ультрафиолетового света. При облучении отдельной митохондрии и ней происходит гашение флуоресценции родамина из-за того, что в результате пробоя внутренней мембраны митохондрии разность потенциалов на ней падает и родамин как бы вытекает из матрикса митохондрии. При этом соседние митохондрии не меняют своего свечения и продолжают синтез АТФ. Что же произойдет, если облучить небольшой участок разветвленной или же очень длинной митохондрии? В эксперименте одна из протяженных светящихся митохондрий фибробласта была локально поражена узким (0,5 мкм) микролучом оптического лазера. В результате этого вся длинная митохондрия потухла, в то время как соседние оставались без изменений (см. рис. 216, б). Поражение микролучом участков свободной от митохондрии цитоплазмы не приводило к тушению митохондрий. Это говорит о том, что точечный пробой мембраны митохондрии приводит к снятию разности потенциалов не только в точке пробоя, но по всей длине митохондрии, которая представляет собой проводник с эквипотенциальной поверхностью. Следовательно, такие длинные нитчатые митохондрии фибробластов могут представлять собой электрические проводники, могущие передавать разность потенциалов на митохондриальных мембранах на большие расстояния и объединять удаленные участки цитоплазмы.
|
Рис. 216. Локальное повреждение нитчатой митохондрии фибробласта лазерным микролучом, приводящее к деэнергизации всей митохондрии (по: Бакеева, Ченцов, 1989) а — флуоресценция этилродамина в митохондриях интактной клетки. Стрелка указывает на место лазерного укола; б — та же клетка после локального облучения: поврежденная митохондрия потеряла флуоресценцию; в — вид митохондрий той же клетки в фазовом контрасте |
Это значит, что и в случае гигантских разветвленных митохондрий в любой ее точке на внутренней мембране может накопиться потенциал, достаточный для того, чтобы начался синтез АТФ. С этих позиций митохондриальный ретикулум представляет собой как бы электрический проводник, кабель, соединяющий отдаленные точки такой системы. Митохондриальный ретикулум может оказаться очень полезным не только для мелких подвижных клеток, таких как хлорелла, но и для более крупных, там, где требуются кооперация и синхронизация в работе многих структурных единиц, таких как, например, миофибриллы в скелетных мышцах.
Как известно, скелетные мышцы состоят из массы мышечных волокон — симпластов, содержащих множество ядер. Длина таких мышечных волокон достигает 40 мкм при толщине 0,1 мкм — это гигантская структура, содержащая великое множество миофибрилл, которые сокращаются одновременно, т.е. синхронно. Для такого сокращения к каждому саркомеру миофибрилл должно быть доставлено большое количество АТФ. На продольных ультратонких срезах скелетных мышц в электронном микроскопе видны многочисленные округлые мелкие сечения митохондрий, располагающихся в соседстве с саркомерами (рис. 217). Если же исследовать поперечные срезы мышечных волокон на уровне Z-дисков, то видно, что мышечные митохондрии представ ляют собой не мелкие шарики или палочки, а как бы паукообразные структуры, отростки которых могут ветвиться и простираться на большие расстояния, иногда через весь поперечник мышечного волокна. При этом разветвления митохондрий окружают каждую миофибриллу в мышечном волокне, снабжая их АТФ, необходимого для мышечного сокращения. Следовательно, в плоскости Z-диска митохондрии представлены типичным митохондриальным ретикулумом — единой митохондриальной системой. Такой пласт, или этаж, митохондриального ретикулума повторяется дважды на каждый саркомер, а все мышечное волокно имеет тысячи поперечно расположенных «поэтажных» пластов митохондриального ретикулума. Обнаружено, что между «этажами» вдоль миофибрилл располагаются нитчатые митохондрии, соединяющие эти митохондриальные пласты. Тем самым создается трехмерная картина митохондриального ретикулума, проходящего через весь объем мышечного волокна (рис. 218).
|
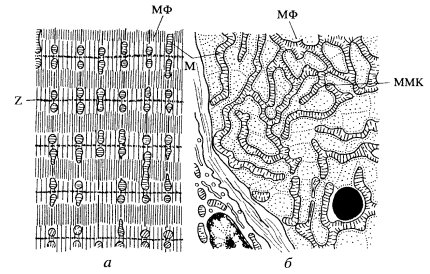
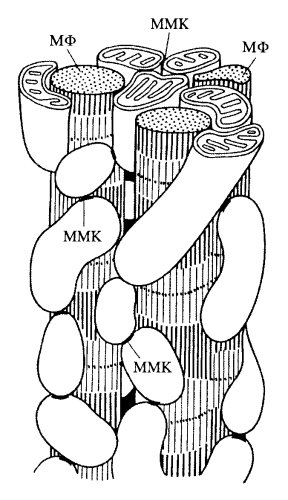
Рис. 217. Расположение митохондрий в поперечно-полосатой мышце диафрагмы крысы (по данным Л.Е. Бакеевой и Ю.С. Ченцова) а — продольный срез; б — срез на уровне Z-диска. М — митохондрии; ММК — межмитохондриальные контакты; МФ — миофибриллы |
|
Рис. 218. Схема трехмерной организации митохондриального ретикулума в скелетной мышце |
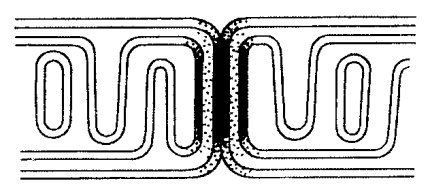
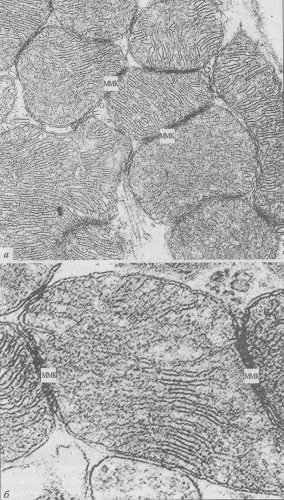
Как между ответвлениями митохондриального ретикулума, так и между ними и нитевидными продольными митохондриями существуют специальные межмитохондриальные соединения, или контакты (ММК). Они образованы плотно прилегающими наружными митохондриальными мембранами контактирующих митохондрий, межмембранное пространство и мембраны в этой зоне имеют повышенную электронную плотность (рис. 219). Было сделано предположение, что через эти специальные образования может происходить функциональное объединение соседних митохондрий и митохондриальных ретикулумов в единую, кооперативную энергетическую систему. Все миофибриллы в мышечном волокне сокращаются синхронно по всей их длине, следовательно, и поступление АТФ на любом участке этой сложной машины тоже должно осуществляться синхронно, а это может происходить лишь в том случае, если огромное количество разветвленных митохондрий-проводников будет связано друг с другом клеммами-контактами (ММК).
|
Рис. 219. Схема строения межмитохондриального контакта |
Доказать то, что ММК действительно участвуют в энергетическом объединении митохондрий друг с другом, удалось на другом типе поперечно-исчерченнных мышц — на кардиомиоцитах (клетках сердечных мышц). Оказалось, что хондриом клеток сердечной мышцы не образует ветвящихся структур, а представлен множеством небольших вытянутых митохондрий, располагающихся без особого порядка между миофибриллами. Однако все соседние митохондрии стыкуются друг с другом с помощью митохондриальных контактов такого же типа, как в скелетной мышце, только их число очень велико: в среднем на одну митохондрию приходится 2- 3 ММК, которые связывают митохондрии в единую цепь, где каждым звеном такой цепи (streptio mitochondriale) является отдельная митохондрия (рис. 220). Такой тип хондриома также может служить целям синхронного сокращения всех саркомеров в миофибриллах кардиомиоцитов. Для такой кооперативной координации митохондрий должны служить множественные межмитохондриальные контакты (рис. 221 и 222).
|
Рис. 220. Схема расположения митохондрий в клетке сердечной мышцы (по: Бакеева, Ченцов, 1989) ММК — межмитохондриальные контакты; МФ — миофибриллы |
|
Рис. 221. Межмитохондриальные контакты (ММК) в кардиомиоцитах левого желудочка крысы а — показана множественность ММК; б — ультраструктура ММК (фото Т.В. Липиной) |
|
Рис. 222. Кардиомиоцит крысы (фото Т.В. Липиной) Межмитохондриальные контакты (ММК) объединяют ряд митохондрий (М) в цепочечную систему митохондриального ретикулума (streptio mitochondriale). МФ — миофибриллы |
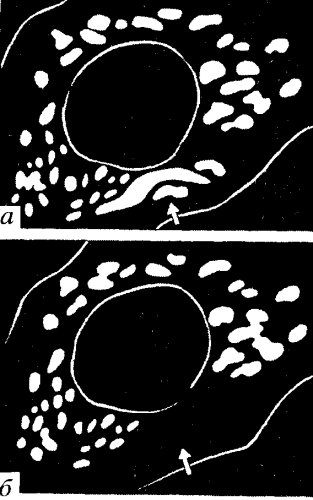
Для доказательства этой гипотезы были использованы кардиомиоциты эмбрионов крысы в культуре ткани. Эти клетке имеют гетерогенные по размеру и форме митохондрии, расположенные между миофибриллами (рис. 223). В электронном микроскопе между некоторыми митохондриями были видны ММК, объединяющие их в небольшие группы - кластеры. В дальнейшем были проведены эксперименты, аналогичные тем, которые были сделаны на культуре фибробластов: митохондрии живых кардиомиоцитов окрашивали этилродамином, а затем одну из митохондрий в группе облучали лазерным микропучком. Облучение одиночных митохондрий приводило к быстрому их гашению. В одних случаях погасала только облученная митохондрия, в других - теряла люминесценцию вся группа митохондрий (рис. 224). Электронная микроскопия показала, что в последнем случае митохондрии в кластере были связаны друг с другом с помощью ММК. Следовательно, если одиночные митохондрии теряют этилродамин после лазерного укола вследствие электрического пробоя митохондриальной мембраны, то гашение группы митохондрий, связанных ММК, доказыва ет, что ММК, как клеммы, объединяют в единую цепь потенциалы одиночных митохондрий. По всей вероятности, области ММК проницаемы для протонов, которые могут передаваться с внутренней митохондриальной мембраны одной митохондрии на внутреннюю мембрану другой и тем самым объединять митохондрии в единую энергетическую систему.
|
Рис. 223. Флуоресцирующие митохондрии кардиомиоцита при окраске этилродамином |
|
Рис. 224. Гашение группы митохондрий кардиомиоцита после облучения одной из митохондрий (показано стрелкой) (по: Бакеева, Ченцов, 1989) а — флуоресцирующие митохондрии до облучения; б — то же после облучения |
Как оказалось, межмитохондриальные контакты, как обязательная структура сердечных клеток, встречаются не только у крыс. Они обнаружены в кардиомиоцитах как желудочков, так и предсердий всех позвоночных животных: млекопитающих, птиц, пресмыкающихся, амфибий и костистых рыб. Более того, ММК были выявлены (но в меньшем числе) в клетках сердца некоторых насекомых и моллюсков. Эти наблюдения говорят о чрезвычайно важной биологической роли этих структур, характеризующих митохондрии интенсивно и постоянно работающих клеток сердца.
Количество ММК в кардиомиоцитах изменяется в зависимости от функциональной нагрузки на сердце. Так, если у крыс вызвать экспериментальное усиление работы сердечной мышцы, например при компенсаторной гипертрофии миокарда (частичная перевязка аорты), то количество ММК увеличивается почти вдвое. Увеличивается число ММК и при повышении физических нагрузок животных. Наоборот, при ограничении подвижности животных, находящихся в тесных камерах более четырех месяцев (как в космическом корабле), при падении нагрузки на сердечную мышцу происходит резкое сокращение числа ММК.
Те же закономерности наблюдаются и у других животных в естественных условиях их жизни. Так, уменьшается число ММК у зимних спящих летучих мышей, у зимующих сурков. Резко возрастает число ММК в кардиомиоцитах летающих стрижей по сравнению с их птенцами до вылета из гнезда. Из этих наблюдений можно сделать обобщение: чем выше функциональная нагрузка на кардиомиоциты, чем выше потребление энергии, тем большее количество ММК связывает отдельные митохондрии в единую кооперативную систему.
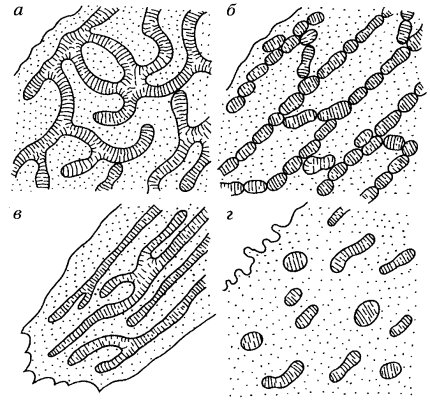
На рис. 225 показаны варианты организации хондриома в различных клетках. Хондриом может иметь различную композицию в зависимости от энергетических потребностей клетки. В простейшем (и чаще встречающемся) случае он может быть представлен множеством разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы. В другом случае длинные и разветвленные митохондрии могут энергетически обеспечивать отдаленные друг от друга участки клетки. Вариантом такой протяженной системы может быть хондриом типа митохондриального ретикулума, который встречается как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот вид хондриома выражен в скелетных мышцах млекопитающих, где группы гигантских разветвленных митохондрий связаны друг с другом с помощью ММК. Вообще же наличие ММК характерно для хондриомов сократимых структур. Особенно обильно ММК представлены в клетках сердечных мышц, где они функционально связывают множественные отдельные митохондрии в единую разветвленную цепь.
|
Рис. 225. Схема различной организации хондриома а — митохондриальная сеть (reticulum mitochondriale); 6 — митохондриальная цепь (streptio mitochondriale); в — нитчатые митохондрии; г — одиночные митохондрии |

Величко В.В. © Copyright 2008.![]()
![]()